Junta de Extremadura
Página Web del Diario Oficial de Extremadura
Ultimos Diarios Oficiales
AVISO: La traducción a portugués deriva de un proceso automático con carácter informativo.Menú principal
Menú Derecha
RESOLUCIÓN de 24 de octubre de 2022, de la Secretaría General, por la que se da publicidad al Convenio de Colaboración entre el Servicio Extremeño de Salud y GENINCODE, SLU, para el desarrollo del Proyecto Piloto CARDIOGENEX.
DOE Número: 220
Tipo: Ordinario
Fecha Publicación: miércoles, 16 de noviembre de 2022
Apartado: III OTRAS RESOLUCIONES
Organismo: CONSEJERÍA DE HACIENDA Y ADMINISTRACIÓN PÚBLICA
Rango: RESOLUCIÓNDescriptores: Convenios. Página Inicio: 55844
Página Fin: 55869
Otros formatos:
TEXTO ORIGINAL
Habiéndose firmado el día 12 de septiembre de 2022, el Convenio de Colaboración entre el Servicio Extremeño de Salud y GENINCODE, SLU, para el desarrollo del proyecto piloto CARDIOGENEX, de conformidad con lo previsto en el artículo 8 del Decreto 217/2013, de 19 de noviembre, por el que se regula el Registro General de Convenios de la Administración de la Comunidad Autónoma de Extremadura.
RESUELVO:
La publicación en el Diario Oficial de Extremadura del convenio que figura como ANEXO de la presente resolución.
Mérida, 24 de octubre de 2022.
La Secretaria General.
PA, Resolución de 01/03/2021,DOE n.º 43, de 4 de marzo de 2021
La Jefa de Servicio de Legislación y Documentación,
M.ª MERCEDES ARGUETA MILLÁN
CONVENIO DE COLABORACIÓN ENTRE EL SERVICIO EXTREMEÑO DE SALUD Y GENINCODE, SLU, PARA EL DESARROLLO DEL PROYECTO PILOTO CARDIOGENEX
Mérida, 12 de septiembre de 2022.
REUNIDOS
De una parte, el Sr. D. Ceciliano Franco Rubio, en nombre y representación del Servicio Extremeño de Salud (en adelante, el SES), en su calidad de Director Gerente de dicho Organismo, cargo para el que fue nombrado por Decreto 194/2015, de 17 de julio (DOE n.º 87, de 18 de julio de 2015), actuando en el ejercicio de la competencia atribuida en el artículo 4.d) del Anexo I del Decreto 221/2008, de 24 de octubre, por el que se aprueban los Estatutos del Organismo Autónomo del Servicio Extremeño de Salud.
De otra parte, GENINCODE, SLU, con domicilio en Rambla d Egara, 235, 5º C-D, 08224 Terrassa, Barcelona y provista de C.I.F. B-67271353, (en adelante, GENINCODE ) representada por D. Jordi Puig Gilberte actuando en su calidad de Administrador de la misma, según consta en la escritura de nombramiento de cargo otorgada ante la Notario del Ilustre Colegio Notarial de Catalunya, Dña. Eva María Corbal San Adrián, el 21 de enero de 2021, número 202 de su protocolo e inscrita en el Registro Mercantil de Barcelona al Tomo 46534, Folio 168 y Hoja 523091
Intervienen las partes en el ejercicio de las facultades que legalmente les confieren los cargos que desempeñan, reconociéndose legitimación para la suscripción del presente convenio y en orden al mismo,
EXPONEN
Primero. El SES es un Organismo Autónomo de carácter administrativo creado por la Ley 10/2001, de 28 de junio, de Salud de Extremadura, adscrito a la Consejería competente en materia sanitaria de la Administración de la Comunidad Autónoma de Extremadura, dotado de personalidad jurídica propia y plena capacidad de obrar para el cumplimiento de sus fines, disponiendo de tesorería propia y facultades de gestión del patrimonio afecto.
El SES tiene como funciones, entre otras, la planificación, organización, dirección y gestión de los centros y de los servicios sanitarios adscritos al mismo, y que operen bajo su dependencia orgánica y/o funcional, así mismo realizará esas mismas funciones en cuanto a la gestión de los recursos humanos, materiales y financieros que le estén asignados para el desarrollo de las funciones que tenga encomendadas. Bajo el ámbito de la Consejería de Sanidad y Servicios Sociales, de la Junta de Extremadura, el SES impulsa la investigación e innovación, fomentando la actividad investigadora en los equipos de profesionales de Atención Primaria para que, en ese concreto nivel asistencial, desarrollen proyectos de investigación de calidad sobre los resultados en salud de la práctica clínica habitual, y cuyas conclusiones puedan ser transferidas al resto de los profesionales del sistema sanitario.
Segundo. Que GENINCODE, es una compañía biotecnológica con una amplia cartera de productos relacionados con enfermedades cardiovasculares de componentes genéticas, para su diagnóstico, la valoración de la predisposición de padecerlas y/o la predicción del riesgo de desarrollar futuros eventos cardiovasculares y entre otros productos, dispone de un test clínico genético CARDIO inCode® (en adelante Producto ). El producto es un test genético de medicina personalizada que mide el riesgo del paciente de padecer un evento cardiovascular, gracias a la integración de su carga genética y sus factores de riesgo cardiovascular clásicos en las ecuaciones de riesgo y propone una serie de recomendaciones para disminuir ese riesgo.
Que GENINCODE tiene un compromiso con el apoyo a la eficiencia de los sistemas sanitarios públicos y la optimización del manejo del paciente, y a tal efecto remitió al SES una propuesta de colaboración para la realización de un Proyecto Piloto con el Producto definido en la siguiente cláusula primera.
Tercero. Que el SES está interesado en colaborar con GENINCODE en el desarrollo y ejecución del Proyecto Piloto CARDIOGENEX, Estudio para el refuerzo de la prevención CARDIOvascular con información GENética en la población EXtremeña, con el objeto de (i) promover la salud y prevenir la aparición de enfermedades cardiovasculares en la población en Extremadura, (ii) mejorar la estimación del riesgo cardiovascular individualizado en el SES (dentro del apartado de desarrollo de la Medicina Personalizada y de Precisión) e (iii) implementar unas buenas prácticas para la prescripción del tratamiento preventivo de las Enfermedades Cardiovasculares considerando la relevancia del marcador genético proporcionado por el Producto en la estimación del riesgo cardiovascular, junto con los factores de riesgo clásico.
Que asimismo ambas partes consideran beneficioso llevar a cabo el Proyecto Piloto, toda vez que puede suponer una mejora en la prevención cardiovascular para la población en Extremadura con riesgo intermedio de sufrir un evento cardiovascular (aproximadamente 52 mil individuos en una franja de edad comprendida entre los 45 y 64 años), así como especialmente para los de riesgo intermedio-alto en esa misma franja de edad (aproximadamente 21 mil individuos) según algunas estimaciones basadas en el estudio HERMEX (Félix-Redondo FJ, et al. REC CardioClinics. 2019. https://doi.org/10.1016/j.rccl.2019.04.011).
Que en virtud de cuanto antecede, las partes intervinientes, siendo coincidentes sus intereses, suscriben el presente convenio, con sujeción a las siguientes
CLÁUSULAS
Primera. Objeto del convenio.
El objeto del presente convenio es establecer los términos y condiciones que regirán la colaboración entre el SES y GENINCODE para la realización de un Proyecto Piloto cuyo objeto es reforzar la prevención cardiovascular primaria y evaluar la utilidad clínica del Producto en un entorno asistencial real ( Proyecto Piloto ) de conformidad con el protocolo del proyecto, elaborado y aprobado por ambas partes y que se adjunta como Anexo 1 al presente convenio ( Protocolo ).
Los investigadores principales designados por el SES, para la realización y seguimiento del Proyecto Piloto son el Dr Miguel Turégano Yedro, Médico de Familia de EAP C.S. Aldea Moret (Cáceres), y el Dr Javier Parra Sánchez, médico de familia. C.S de Almaraz (Cáceres) ( Investigadores Principales ) tal y como consta en el Protocolo.
Segunda. Plazo de vigencia.
El convenio entra en vigor en la fecha de la firma de las partes indicada en el encabezamiento del mismo ( fecha efectiva ).
El presente convenio tendrá una duración de 26 meses desde la fecha efectiva.
No obstante, si con anterioridad a la llegada de la fecha de vencimiento el Proyecto Piloto descrito en la cláusula primera anterior y la acción descrita en el punto 3.1.e) no hubieran finalizado, los firmantes del convenio podrán acordar unánimemente su prórroga por un periodo de hasta dos años adicionales o su extinción una vez finalizado el Proyecto Piloto.
Tercera. Obligaciones y actuaciones a realizar por las partes.
Durante la vigencia del presente convenio y para la realización del Estudio Piloto, las partes se comprometen a colaborar mutuamente y a mantenerse puntual y debidamente informadas de cualquier incidencia o novedades relativas al Proyecto Piloto participando en la Comisión de Seguimiento, que, entre otras funciones recibirá informes periódicos de reclutamientos e informes preliminares si se considerasen.
3.1. El SES, en particular, se compromete a realizar las siguientes actuaciones:
a) Poner a disposición del Proyecto Piloto los recursos humanos y tecnológicos necesarios para llevarlo a cabo. Para realizar el Proyecto Piloto, estarán involucrados entre 60 y 65 unidades básicas asistenciales de la Atención Primaria.
b) Poner a disposición del desarrollo del Proyecto Piloto los medios profesionales y materiales necesarios. Esto incluirá las visitas médicas y de enfermería necesarias, las pruebas complementarias en forma de análisis sanguíneos y las intervenciones farmacológicas o no para el control de los factores de riesgo y en base a la práctica clínica habitual.
c) Realizar las gestiones relativas a la obtención de las muestras de los pacientes analizados con el Producto definidas en el Apartado A) del Anexo 2 al convenio.
d) Obtener todas las autorizaciones que sean necesarias para la correcta y adecuada realización del Proyecto Piloto (incluyendo la autorización del Comité Ético y el consentimiento informado de los pacientes), en el menor plazo posible para el cumplimiento de los plazos establecidos en el apartado 2 anterior. En ese sentido, GENINCODE se compromete a colaborar con el SES en lo que razonablemente sean necesario para la obtención de la autorización dentro del plazo indicado.
e) Evaluar y aprobar, a la conclusión del Proyecto Piloto, y en colaboración con GENINCODE, el análisis de los resultados y datos obtenidos en función de los objetivos marcados y el cálculo de los indicadores de consecución acordados en el Protocolo. También se realizará una evaluación del impacto presupuestario de la introducción del Producto a nivel asistencial en la población diana definida. Dichos resultados y conclusiones finales se recibirán de la Comisión de Seguimiento establecida y definida en el siguiente Cláusula Quinta, para su evaluación y aprobación, durante el mes siguiente a la finalización del Proyecto Piloto.
Si los resultados demuestran el cumplimento de los indicadores de consecución de los objetivos establecidos en el Protocolo, se iniciaría el proceso de negociación entre el SES y GENINCODE para evaluar la incorporación del Producto en la práctica clínica en Atención Primaria del SES.
3.2 GENINCODE, por su parte, se compromete a realizar las siguientes actuaciones:
a) Colaborar con el SES en la organización del trabajo de campo y en la formación en relación a la inclusión de los médicos reclutadores y los pacientes, así como proponer para valoración de los Investigadores Principales del Protocolo la intervención más adecuada a realizar y el manejo de las tecnologías propias.
b) Suministrar el Producto y prestar los servicios establecidos en el apartado B) del Anexo 2 al convenio para el número de pacientes incluidos en el Protocolo, sin coste para el SES.
c) Prestar apoyo durante la realización del Proyecto Piloto, en base a las acciones definidas en el Protocolo y en el análisis de las conclusiones referido en la anterior cláusula 3.1 c): suministrar el Producto, gestionar el transporte de las muestras, realizar el análisis genético, emitir los informes de resultados, ofrecer formación y apoyo logístico y científico a los equipos del SES involucrados en Proyecto Piloto (ver apartado B ANEXO 2).
Cuarta. Financiación del convenio.
Para el SES la realización del Proyecto Piloto no supone costes añadidos puesto que la valoración del riesgo cardiovascular ya está establecida dentro de la cartera de servicios del SES y es práctica clínica habitual.
Quinta. Comisión de Seguimiento del Proyecto Piloto.
Con el objeto de garantizar la ejecución de este convenio y el cumplimiento de sus fines se constituirá una Comisión de Seguimiento, formada por dos representantes de cada una de las Entidades firmantes.
Dos (2) representantes del SES: Doña Asunción Campos Cangas, (Subdirectora de Atención Primaria), Don Francisco Javier Félix Redondo (Responsable Médico, Dirección General de Asistencia Sanitaria), Dos (2) representantes de GENINCODE: Don Jordi Puig Gilberte (Director General), Doña Marie Laurent (Directora de Market Access), los Investigadores Principales del Estudio, D. Miguel Turégano y D. Javier Parra Sánchez. Cualquier cambio en los representantes designados por las partes en el presente convenio deberá comunicarse por escrito y con carácter previo a la otra parte y a los Investigadores Principales.
La Comisión de Seguimiento determinará internamente su régimen de funcionamiento y le corresponderá, además de monitorizar el cumplimiento de las actuaciones y obligaciones de las partes indicadas en la anterior cláusula 3, las siguientes tareas:
a) Velar por la ejecución del objeto del presente convenio y el seguimiento del Protocolo.
b) Proponer a las partes firmantes cuantas medidas complementarias se estimen necesarias para el mejor cumplimiento de los fines previstos del Proyecto Piloto o modificaciones al Protocolo.
c) Efectuar la evaluación y seguimiento de las acciones que se vayan a llevar a cabo bajo el marco del convenio y del Proyecto Piloto.
d) Proponer prorrogar el Proyecto Piloto con objeto de finalizar aquellas tareas necesarias establecidas en el Protocolo y pendientes de realizar en la fecha de finalización inicial prevista en la anterior cláusula 2 o la realización de aquellas actividades ulteriores o adicionales que se consideren necesarias para el buen fin del Proyecto Piloto.
e) Realizar el análisis e interpretación de los resultados del Proyecto Piloto, elaborando y revisando los documentos y la memoria incluyendo los resultados y, en su caso, la propuesta de implantación del Producto dentro de la cartera de servicios del SES. La realización de los análisis se podrá externalizar, a criterio del Comité de Seguimiento, a una empresa experta en este ámbito.
f) Proponer y revisar las publicaciones a realizar relativas al Proyecto Piloto.
g) Resolver los aspectos no previstos en el presente convenio que pudieran surgir durante su vigencia, así como aclarar las dudas que pudieran plantearse en su interpretación, ejecución y prórroga.
El régimen jurídico de esta Comisión de Seguimiento será el establecido en la Sección 3ª del Capítulo II del Título Preliminar de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, para los órganos colegiados.
Sexta. Propiedad intelectual e industrial.
La titularidad de todos los derechos de propiedad industrial sobre el Producto pertenece a la sociedad GENINCODE Plc., sociedad matriz de GENINCODE y de la que ésta última es licenciataria en exclusiva en España, entre otros territorios.
En consecuencia, en el supuesto de que se obtengan resultados susceptibles de explotación industrial (patentes, propiedad intelectual, derechos de explotación, mejoras, modificaciones, nuevas aplicaciones etc.) derivados del Proyecto Piloto, , siempre y cuando se refieran al Producto, pertenecerán exclusivamente a GENINCODE Plc y en este sentido se estará lo dispuesto en la Ley 24/2015, de 24 de julio, de Patentes, respecto de las invenciones laborales, así como los artículos 51 y 97.4 del Real Decreto Legislativo 1/1996, de 12 de abril, por el que se aprueba el Texto Refundido de la Ley de Propiedad Intelectual, regularizando, aclarando y armonizando las disposiciones legales vigentes sobre la materia. El SES cederá y transferirá a GENINCODE Plc., o a quien esta designe, todos los derechos de propiedad industrial sin derecho a percibir compensación alguna por dicho motivo. Asimismo, en la medida que sea necesario por requerimientos regulatorios o legales, el SES dará acceso a GENINCODE de los datos resultantes del Proyecto Piloto con el exclusivo fin de dar cumplimiento a dichos requerimientos.
Cualquier dato que se proporcione habrá sido previamente pseudonimizado convenientemente y según dictamine el comité de ética de la investigación correspondiente.
Séptima. Difusión de los resultados del Proyecto Piloto y comunicados de prensa.
Es intención de ambas partes difundir los resultados del Proyecto Piloto. No obstante, la publicación y/o divulgación de los resultados del Proyecto Piloto, bien sean parciales o finales, independientemente de su forma o medios, deberá ser previamente consensuada y aprobada por el Comité de Seguimiento. No obstante, GENINCODE, podrá retrasar la publicación por causas justificadas (ejercicio de los derechos de protección mediante patente) y/o eliminar la Información Confidencial (tal y como este término se define en la siguiente cláusula 8) con carácter previo a su publicación.
En todo caso, la publicación de los resultados del Proyecto Piloto se realizará en revistas científicas y su divulgación en seminarios y conferencias dentro del ámbito profesional médico, siempre que se respete lo establecido en el anterior apartado.
A efectos de contribuir a la visibilidad de la colaboración recogida en el presente convenio, en la difusión que de las actividades que realicen cualquiera de las partes, se deberá hacer referencia a las partes firmantes.
Especialmente en las publicaciones o cualquier otra forma de difusión de los resultados a que den lugar las actuaciones realizadas se deberá reconocer y hacer constar la participación de las partes, salvo renuncia expresa de alguna de ellas.
Asimismo, las partes podrán realizar, si así lo acuerdan, comunicados de prensa conjuntos.
Octava. Confidencialidad.
Los datos e información intercambiada entre las partes, con anterioridad o con posterioridad a la firma del presente convenio relativa al Producto y/o el Proyecto Piloto y/o la ejecución del mismo y/o cualquier otro dato y/o información derivada y/o relacionado con el objeto del presente convenio, así como los resultados obtenidos tendrán carácter confidencial ( Información Confidencial )
No tendrá carácter de información confidencial aquella información respecto a la cual la parte receptora puedan demostrar que:
a) Obraba en su poder con anterioridad a la firma de este convenio y que no la hubiere recibido de la otra parte o de un tercero sujeto a una obligación de confidencialidad.
b) La habían recibido de un tercero con carácter no confidencial, si dicho tercero no está sujeto a una obligación de confidencialidad.
c) Sea de dominio público a la firma del presente convenio, o con posterioridad al mismo haya pasado a ser de dominio público por causa no imputable a la Parte receptora (ej. Publicación conjunta de resultados).
d) Sea requerido por Ley o por autoridad competente.
La información confidencial recibida la utilizará la parte receptora única y exclusivamente en relación con el fin para el que fuera revelada y en cualquier caso dentro del ámbito del objeto del presente convenio y sólo para los usos previstos en el mismo, no pudiendo ser utilizada para otro fin y no pudiendo ser revelada a terceros, ya sean personas físicas o jurídicas, ni divulgada mediante su publicación en cualquier medio de comunicación, o difundida de cualquier otra forma, sin la previa autorización escrita de la parte reveladora de la información confidencial.
Las partes se comprometen a devolver, inmediatamente y en cualquier momento que la parte reveladora se lo exija o a la finalización del presente convenio, por cualquier causa, toda la información confidencial de las otras partes que obre en su poder, firmando declaración en tal sentido, conforme no han retenido copia o archivo alguno.
Cuanto antecede no será interpretado en el sentido de que constituya para la parte receptora de la información confidencial la prohibición de dedicarse en el futuro a cualquier otra actividad profesional o de colaboración similar al objeto del presente convenio, excepto en el caso de que esa nueva actividad o colaboración implique la utilización de la información confidencial.
Las partes quedan vinculadas por la obligación de secreto que aquí se pacta por toda la duración del convenio y aún después de expirado el plazo contractual previsto, por un plazo de cinco (5) años a contar desde la fecha de dicha expiración contractual, o bien hasta que la información confidencial pase a ser de dominio público por causa distinta a un acto u omisión de la parte receptora, lo que sea posterior.
Novena. Datos de carácter personal.
Considerando que el Proyecto Piloto puede suponer el manejo de datos personales, el SES y el personal responsable de realizar el Proyecto Piloto por parte del SES tienen el deber de preservar muy especialmente la confidencialidad sobre los datos personales o clínicos, de los sujetos del Proyecto Piloto, adoptando todas aquellas medidas de seguridad y técnicas establecidas en la legislación de protección de datos actual y de la ley de investigación biomédica.
Esta obligación de confidencialidad subsistirá incluso una vez finalizados los trabajos objeto del presente convenio.
Se deja constancia de que GENINCODE actuará como encargado de tratamiento del SES y ésta acepta que el acceso y uso de cualesquiera plataformas y sistemas bajo su control (ej. SITAB, plataforma digital de GENINCODE que contempla todas las medidas de seguridad desde el punto de vista de la protección de datos, e incluye desde un sistema logístico de recogida de muestras que permite ser más eficiente con la entrega de los resultados en los tiempos previstos, la incorporación y mantenimiento de los algoritmos genéticos/clínicos, y de la oportunidad de disponer y poder consultar cualquier informe solicitado anteriormente (repositorio de informes) que sea necesario para la ejecución del Proyecto Piloto, requerirá la previa aceptación de los correspondientes términos y condiciones de uso y la política de privacidad de GENINCODE.
Cualesquiera datos de pacientes que el SES proporcione a GENINCODE para su procesamiento con el Producto, deberán ir previamente pseudonimizados, a fin y efecto de que GENINCODE no pueda vincular los datos clínicos remitidos con su titular.
De acuerdo con la normativa de protección de datos, los legales representantes firmantes de este convenio reconocen quedar informados y consentir que sus datos personales, así como los que sean generados durante la ejecución de la relación contractual, sean incorporados a un fichero titularidad de cada parte respectivamente, con la finalidad de llevar a cabo la gestión, desarrollo, cumplimiento y control de la relación contractual.
Por otro lado, quedan informados acerca de la posibilidad de ejercitar sus derechos de acceso, rectificación, oposición, portabilidad (en algunos casos), cancelación y supresión dirigiéndose por escrito a las direcciones postales indicadas en el encabezamiento del presente convenio.
Décima. Responsabilidades derivadas del convenio.
Los contratos celebrados por cada una de las partes firmantes del convenio con terceros en ejecución de las actuaciones objeto de este convenio serán de su exclusiva responsabilidad, efectuándose a su riesgo y ventura.
Este convenio no supone asociación alguna o dependencia entre las partes firmantes, que actuarán de forma independiente y autónoma, siendo obligación específica y exclusiva de cada parte cumplir con cuantas obligaciones legales le correspondan en desarrollo de su actividad de acuerdo con la normativa que les resulte de aplicación, en particular en lo que hace referencia al personal dependiente de las mismas y puesto a disposición para la ejecución de las obligaciones asumidas por cada una de ellas, que no tendrá relación laboral alguna con la otra parte interviniente.
Undécima. Modificación del convenio.
Cualquier modificación del convenio que se realice con posterioridad a la suscripción del mismo requerirá acuerdo de las partes y deberá documentarse por escrito por medio de una adenda que se incorpore al mismo.
Decimosegunda. Causas de extinción y resolución del convenio.
El convenio se extinguirá de conformidad con lo estipulado en la Cláusula segunda, a la finalización de la actividad contemplada en el Anexo I, sin necesidad de preaviso alguno por las partes, salvo que se acuerde su prórroga o por incurrir alguna de las partes en causa de resolución.
Serán causas de resolución del presente convenio las siguientes:
a) La finalización del Proyecto Piloto.
b) El acuerdo expreso y unánime de las partes firmantes.
c) El incumplimiento de las obligaciones y compromisos asumidos. En este caso, cualquiera de las partes podrá notificar a la parte incumplidora un requerimiento para que cumpla en un plazo de treinta (30) días con las obligaciones o compromisos que se consideran incumplidos. Si trascurrido el plazo indicado en el requerimiento persistiera el incumplimiento, la parte que lo dirigió notificará a la otra parte firmante la concurrencia de la causa de resolución y se entenderá resuelto el convenio.
d) Por decisión judicial declaratoria de la nulidad del convenio.
Cada una las partes se compromete a comunicar a tiempo a la otra parte toda dificultad, de cualquier naturaleza que ésta sea, que encuentre en el desarrollo de la ejecución de sus obligaciones en el marco del presente convenio y, en general, toda información susceptible de afectar a su buena ejecución, con el fin de permitir tomar las medidas que consideren más apropiadas.
Terminada que sea por cualquier causa el presente convenio, ambas partes se comprometen a:
a) Devolverse mutuamente la Información Confidencial que tuviera cada parte en su posesión.
b) Cumplir con todas aquellas obligaciones que se hubieran devengado con anterioridad a la terminación del convenio y/o con las que por su especial naturaleza deban subsistir tras dicha resolución.
Decimotercera. Notificaciones.
Todas las notificaciones y comunicaciones de carácter legal, en relación al presente convenio que deban realizar entre las partes deberán ser por escrito, dirigidas a las personas detalladas a continuación y remitidas por, correo certificado, servicio de mensajería con acuse de recibo, burofax o cualquier otro medio, incluido el correo electrónico que permita obtener acuse de recibo efectivo a los Investigadores Principales designados por cada Parte en las direcciones indicadas en el encabezamiento del presente convenio.
Decimocuarta. Acuerdo completo.
El presente convenio y sus ANEXOs, forman el acuerdo completo entre las partes respecto al objeto del mismo, sustituyendo a cualquier acuerdo o contrato, verbal o escrito, que pudiera existir entre las partes con anterioridad.
Los ANEXOs a este convenio formarán parte integrante del mismo a todos los efectos.
Decimoquinta. Régimen jurídico y resolución controversias.
El presente convenio tiene carácter administrativo y se suscribe al amparo de los artículos 47 a 53 de la Ley 40/2015, de 30 de octubre, de Régimen Jurídico del Sector Público, quedando excluido de la aplicación de la Ley 9/2017, de 8 de noviembre, de Contratos del Sector Público, por la que se transponen al ordenamiento jurídico español las Directivas del Parlamento Europeo y del Consejo 2014/23/UE y 2014/24/UE, de 26 de febrero de 2014, conforme a lo establecido en el artículo 6 de dicha norma, siéndole de aplicación en defecto de normas específicas, los principios del citado texto legal, para resolver las dudas o lagunas que pudieran producirse.
Su interpretación, cumplimiento y ejecución, en caso de discrepancias, corresponderá al orden contencioso-administrativo, de acuerdo con lo previsto en la Ley 29/1998, de 13 de julio, reguladora de la Jurisdicción Contencioso-administrativa.
Y en prueba de conformidad con su contenido, las partes firman el presente convenio por cuadruplicado y a un solo efecto en el lugar y fecha que se indica en el encabezamiento.
Por el SES,
Director Gerente,
Ceciliano Franco Rubio
Por GENINCODE, SLU,
Administrador,
Jordi Puig Gilberte
ANEXO 1
PROPUESTA DE PROTOCOLO
PROYECTO CARDIOGENEX
Prueba de implementación de CARDIO inCode® en el SES
Título Estudio para el refuerzo de la prevención CARDIOvascular con información GENética en la población Extremeña.
Promotor: Servicio Extremeño de Salud (SES).
Investigadores principales: Dr Miguel Turégano Yedro, Médico de Familia de EAP. C.S. Aldea Moret (Cáceres); Dr Javier Parra Sánchez, médico de familia. C.S de Almaraz (Cáceres).
Antecedentes y justificación:
Los Estudios HERMEX (1) y DARIOS (2) muestran que existe una alta prevalencia de los factores de riesgo cardiovasculares en la población extremeña. EL Plan Integral de Enfermedades Cardiovasculares de Extremadura (PIEC) ha sido elaborado para reducir la morbimortalidad de las enfermedades cardiovasculares, especialmente la Cardiopatía Isquémica. Esta enfermedad constituye la primera causa de mortalidad, entre las cardiovasculares en Extremadura, llegando al 29% de la mortalidad cardiovascular total (3,4).
La mayoría de los eventos coronarios ocurren en la clase de riesgo intermedio de la función de riesgo REGICOR (5), lo que demuestra la necesidad de una mejor valoración del riesgo cardiovascular de estos pacientes.
Dado que la genética contribuye en aprox. un 50% en el riesgo cardiovascular (6, 7), existe actualmente un auge de las puntuaciones o scores de riesgo poligénicos. Estos scores permiten integrar el perfil genético individual a las funciones de riesgo clásicas, informando del riesgo coronario adicional y evaluando el riesgo cardiovascular global del paciente (7-10).
CARDIO inCode® es un test predictivo coronario validado en más de 80.000 pacientes de diferentes etnias (6,7), el cual integra el factor de riesgo genético en las funciones clásicas para mejorar la estratificación del riesgo cardiovascular, y ha demostrado su coste-eficacia especialmente en la categoría de riesgo intermedio-alto (11).
Este estudio, sobre la implementación de una nueva estrategia predictiva clínico-genética (CARDIO inCode®), pretende incrementar la eficacia de las estrategias de la prevención primaria de la enfermedad cardiovascular y reforzar el rol de la Atención Primaria en el manejo de los factores de riesgo cardiovasculares, identificando nuevos pacientes de alto riesgo cardiovascular e interviniendo en ellos de una manera más individualizada y efectiva.
Además, en el contexto actual de la COVID-19, numerosos análisis han evidenciado desde el inicio de la pandemia la mayor vulnerabilidad frente a la enfermedad de los pacientes con riesgo cardiovascular alto (12,13). Esta situación refuerza la necesidad de tener bien identificados a estos pacientes, para asegurar un buen control de sus factores de riesgo cardiovascular, sensibilizarlos sobre la necesidad de seguir cuidadosamente las estrategias de prevención frente al SARS-COV2. Por consiguiente, una óptima identificación de estos pacientes y un adecuado manejo clínico-terapéutico (14) de los mismos puede, al perseguir disminuir su potencial mayor vulnerabilidad frente a la COVID-19, ayudar también a disminuir la presión asistencial sobre el sistema sanitario, demasiado tensionado aún con la situación actual.
Objetivo principal:
Determinar el cambio de nivel de riesgo cardiovascular a 12 meses que se deriva de añadir la información genética a la estimación clásica del riesgo cardiovascular comparado con un grupo sin determinación genética, en Extremadura.
Objetivos secundarios:
Analizar el impacto del uso de CARDIO inCode® en estos pacientes, analizando varios indicadores de salud cardiovascular:
— Reducción del riesgo global en los pacientes reclasificados al alza por CARDIO inCode®.
— Reducción del riesgo cardiovascular global en los pacientes no reclasificados al alza con CARDIO inCode®.
— % de cambio en el manejo terapéutico.
— % de reducción de los factores de riesgo clásicos.
— % de mejoría a nivel de adherencia al tratamiento farmacológico y otras pautas higiénico-dietéticas recomendadas.
— Cambios en la calidad de vida.
— Acontecimientos adversos.
MÉTODOS
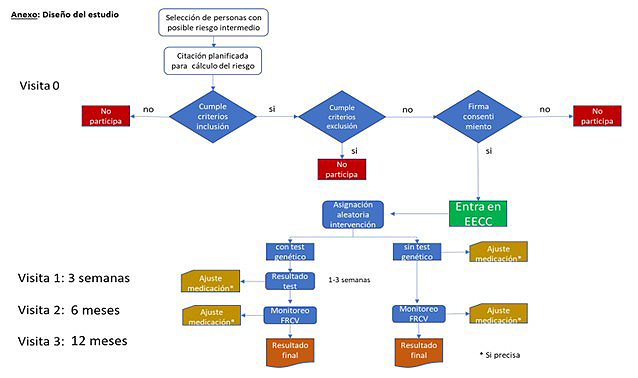
Diseño del estudio:
Se trata de un ensayo clínico cuya intervención consiste en asignación aleatoria a la prueba genética CARDIO inCode® frente a la práctica clínica habitual en al menos 522 personas con riesgo cardiovascular intermedio para determinar si el conocimiento del componente de riesgo genético mejora su riesgo cardiovascular en 12 meses, con un análisis intermedio de los objetivos del estudio a los 6 meses. Para ello será necesaria la participación de entre 60 y 65 unidades básicas asistenciales de la atención primaria que se ocuparan de reclutar a los pacientes, asignar la intervención y seguir el protocolo del estudio.
Población del estudio:
Los criterios de inclusión serán:
— Pacientes de ambos géneros (50% mujeres), de edad comprendida entre 45 y los 65años en hombres y entre 50 y 70 años en mujeres.
— Con un riesgo cardiovascular a 10 años según la función de REGICOR entre el 7,7% y el 9,9%.
— Con seguimiento clínico de 12 meses en cualquiera de los centros participantes.
— Disponibilidad de información sobre los datos demográficos y clínicos requeridos.
— Disponibilidad de una muestra de sangre para extracción de ADN y estudio genético y realización del análisis de factores de riesgo metabólico y función renal.
— Haber proporcionado consentimiento informado por escrito.
Los criterios de exclusión serán:
— No cumplir con los criterios de inclusión.
— Pacientes que hayan padecido alguna enfermedad cardiovascular como cardiopatía isquémica o ictus.
— Pacientes con enfermedad renal crónica estadio 4 o superior (FGe < 30 ml/min).
— Pacientes con alguna enfermedad con pronóstico de vida limitado a menos de 2 años, a criterio del médico de referencia.
— Pacientes con claudicación intermitente.
— Pacientes con arteriosclerosis subclínica conocida: Pacientes con ITB realizado < 0.90, o con ecografía carotídea realizada con íntima-media 1.5 mm, o con calcio intracoronario realizado con CAC score 300 unidades o 75th percentil por edad y, sexo correspondiente.
— Pacientes con enfermedad mental grave (depresión mayor, trastorno bipolar, esquizofrenia).
Tamaño de la muestra.
Aceptando un riesgo alfa del 5% y un poder estadístico >85% en un contraste bilateral, se necesitan 261 sujetos en el grupo con determinación genética y 261 en un grupo sin determinación genética para detectar una diferencia igual o superior a 0,7 unidades porcentuales en la reducción del riesgo a 12 meses. Se asume una desviación estándar de 4 unidades porcentuales y que la correlación entre la primera y la segunda medida es de 0.8. Se ha estimado una tasa de pérdidas de seguimiento del 10%.
Esquema de visitas
El esquema de visitas de reclutamiento y de seguimiento propuestas es el siguiente:
1. Previamente a la Visita 0, se realizará la selección de los pacientes en base a perfiles de riesgo definidos, compatibles con la franja de riesgo intermedio-alto. (7,7%-9,9%).
2. Visita 0 (meses 2 a 4): basal (todos los pacientes): Informar al paciente y solicitar consentimiento informado.
Obtención de muestras biológicas, solicitud de analíticas (bioquímica y genética CARDIO inCode®) y medición de los factores de riesgo necesarios para la estimación del riesgo (tabaquismo, presión arterial, perfil lipídico, diabetes mellitus). Firma del consentimiento informado. Programación de analítica, toma de presión arterial y visita a los 6 meses para todos los pacientes.
3. Genotipado y preparación de informes a pacientes aleatorizados a CARDIO inCode®.
4. Visita 1 (meses 3 a 6): A las 3 semanas (a todos los que se ha realizado CARDIO inCode®): Explicación de los resultados y del informe del test CARDIO inCode®. Fijar nuevos objetivos: protocolo más intensivo en los pacientes reclasificados a riesgo más alto con CARDIO inCode®.
5. Visita 2 (meses 8 a 10): A los 6 meses, a todos los pacientes:
A los pacientes sin test CARDIO inCode®: Seguimiento del grado de control de sus factores de riesgo según la práctica clínica habitual.
Recálculo del riesgo CV global.
A los pacientes a quien se ha realizado CARDIO inCode®: Seguimiento, revisión de resultados de la analítica y medición de otros factores de riesgo clásicos. Recálculo del riesgo CV global.
6. Visita 3 (meses 14 a 16): A los 12 meses (todos los pacientes): Evaluación final, revisión de los resultados de la analítica y medición de otros factores de riesgo clásicos. Recálculo del riesgo CV global.
7. Análisis de datos y escritura de artículos científicos (meses 17-18)
Diagrama de Gantt del estudio
Información clínica:
Las variables clínicas que se recogerán para cada paciente serán:
— Sexo (hombre/mujer).
— Edad (años).
— Peso y talla.
— Carga de tabaquismo en fumadores actuales y exfumadores de menos de un año (paquetes/año).
— Niveles de colesterol total, cLDL, cHDL y triglicéridos (mg/dL) en ayunas
— Presión arterial (mmHg) (como sugerencia: dos medidas separadas por 2 min, en paciente previamente sentado durante 5 min. En los casos de alta variabilidad entre la primera y segunda toma (mayor de 10 mm de Hg de sistólica y 5 mm de diastólica) se tomará una tercera medida.

— Niveles de glucemia (mg/dL).
— HbA1c.
— Creatinina (filtrado glomerular).
— Filtrado glomerular estimado si lo realiza el laboratorio.
— Antecedentes de: hipertensión arterial; dislipemia; diabetes.
— Tratamiento actual (grupo terapéutico) de: hipertensión arterial; dislipemia; diabetes.
— Antecedentes familiares (de primer grado) de enfermedad cardiovascular precoz (hombres antes de los 55 años y mujeres antes de los 65 años).
— Cuestionario de adherencia al tratamiento.
— Cuestionario SF-12 de calidad de vida.
Acontecimientos de interés.
El estudio evaluará:
Resultado principal.
— Riesgo coronario a 12 meses (análisis intermedio a los 6 meses).
Resultados secundarios.
— Disminución del riesgo cardiovascular (en función de los factores de riesgo clásicos únicamente o con la inclusión de la genética) a los 12 meses (análisis intermedio a los 6 meses).
— La distribución del factor de riesgo genético evaluado mediante CARDIO inCode®.
— La proporción de pacientes que son reclasificados a categorías de riesgo cardiovascular superiores en base a CARDIO inCode®.
— Las diferencias en la evolución de los factores de riesgo clásicos antes y después de la reclasificación del riesgo cardiovascular a 12 meses:
Presión arterial.
Glicemia en ayunas.
HbA1c.
Perfil lipídico.
Peso.
Hábito tabáquico y consumo.
— Calidad de vida con el SF-12.
— Las diferencias en el nivel de adherencia al tratamiento y otras pautas recomendadas antes y después de la reclasificación del riesgo cardiovascular.
Antidiabéticos: no es diabético, se inicia tratamiento, se mantiene dosis y fármaco, aumenta dosis, aumenta número de fármacos, disminuye fármacos/dosis.
Hipolipemiantes: no es dislipémico, se inicia tratamiento, se mantiene dosis y fármaco, aumenta dosis, aumenta número de fármacos, cambio de fármacos, disminuye fármacos/dosis.
Tabaco- 1: no ha fumado nunca, sigue fumando (mismo número paquetes/año), fuma menos (disminuye número paquetes/año), ha dejado de fumar, fuma más que antes (aumenta número paquetes/año).
Tabaco- 2: no ha fumado nunca, se han prescrito fármacos coadyuvantes o actividades grupales de motivación, no se ha hecho ninguna actuación.
Hipertensión: no es hipertenso, se inicia tratamiento, se mantiene dosis y fármaco, aumenta dosis, aumenta número de fármacos, cambio fármacos, disminuye fármacos/dosis.
— Acontecimientos adversos: diagnóstico de cardiopatía isquémica (angor, IAM) o revascularización coronaria, diagnóstico de ictus (isquémico o hemorrágico), fallecimiento de causa CV.
Análisis estadístico:
Se realizará un análisis descriptivo de las variables de interés, en el total de los pacientes y en el grupo de pacientes que son reclasificados al alza.
Según necesidades, se utilizarán métodos paramétricos y no paramétricos estándares para comparar las características de los pacientes de ambos brazos (grupo intervención y grupo control). La variable principal del estudio será la reducción del riesgo CV (REGICOR) respecto al basal. Secundariamente se comparará el porcentaje de pacientes que ha reducido como mínimo en 0,7 unidades porcentuales el riesgo en grupo intervención y en grupo control mediante la prueba de Chi al cuadrado.
Si fuera necesario los resultados se ajustarían en modelos multivariados (lineal múltiple, o logístico) para controlar por potenciales factores confusores.
Plan de administración de datos:
La base de datos Maestra será custodiada en los sistemas de información del SES.
Se elaborará un cuaderno de recogida de datos electrónico (e-CRD) con todas las variables de interés del estudio. A los pacientes se les asignará un número, sin aparecer en ningún momento datos identificativos del paciente en el e-CRD. Los médicos responsables organizarán las citas en el medio asistencial exclusivamente. En una hoja de Excel a parte se correlacionará el número con los datos identificativos del paciente, siendo el SES la única persona que tendrá acceso a estos datos. Se subcontratará una empresa independiente especializada en e-CRF y análisis estadístico.
Aspectos éticos:
El estudio involucra a sujetos humanos y todos los participantes serán informados de los objetivos y procedimientos del proyecto, y firmarán un consentimiento informado para participar en el mismo. El proyecto seguirá la Declaración de Helsinki de la Asociación Médica Mundial, relacionada con los Principios Éticos para la Investigación Médica que Involucra a Sujetos Humanos, el Protocolo Adicional a la Convención sobre Derechos Humanos y Biomedicina sobre Investigación Biomédica (2005) y actualizaciones posteriores (Declaración de Helsinki Fortaleza, Brasil, octubre de 2013), así como la confidencialidad de los datos personales de acuerdo con la normativa vigente: Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos de Carácter Personal y garantía de los derechos digitales y Reglamento (UE) n.º 2016/679 del Parlamento Europeo y del Consejo de 27 de abril de 2016 de Protección de Datos (RGPD). También se respetarán las leyes europeas y nacionales (código deontológico profesional de los Colegios Médicos) relacionadas con la protección de datos y la investigación biomédica (Reglamento General de Protección de Datos de la Unión Europea 2016/679; Ley Española 3/2018; Ley Española 14/2007), y el código de conducta europeo para la integridad de la investigación.
Consentimiento informado:
Antes de iniciar cualquier procedimiento, los pacientes o su representante legal recibirán información oral y escrita sobre el estudio (objetivos, riesgos y beneficios). El consentimiento informado por escrito debe otorgarse después de que el contexto del estudio se haya explicado en su totalidad en un idioma que el sujeto o su representante entiendan fácilmente. El sujeto o su representante también debe tener la oportunidad de hacer preguntas y que esas preguntas sean respondidas a su satisfacción.
El consentimiento informado por escrito debe registrarse de manera adecuada mediante la firma fechada por el sujeto o su representante. El proceso de consentimiento debe estar documentado en la historia clínica del sujeto. Se adjuntará como fichero de documento escaneado.
Resultados esperados:
1. Reducción de riesgo mínimo en 0,7 unidades porcentuales en grupo que se han hecho CARDIO inCode®:
Una reducción de riesgo coronario a 10 años de 0,7 unidades porcentuales implica evitar 7 acontecimientos cardiovasculares a 10 años por cada 1.000 pacientes con riesgo intermedio (riesgo a 10 años del 7,7 al 9,9%) a los que se realice una prueba CARDIO inCode®. Aplicándose al grupo de 261 pacientes en el cual se hará la intervención con CARDIO inCode®, sería prevenir 1,8 eventos a 10 años.
2. Esperamos demostrar que en pacientes de 45 a 65 años en hombres y de 50 a 70 años en mujeres en la franja alta de la categoría de riesgo cardiovascular intermedio (riesgo a 10 años del 7,7 al 9,9%), según la función REGICOR, el componente de riesgo genético en base al test CARDIO inCode® reclasifica un porcentaje significativo de pacientes a categorías de riesgo superiores (al menos un 15%). El manejo clínico de estos pacientes, adaptado a la nueva categoría de riesgo, resulta en una mejora global del riesgo cardiovascular del grupo que recibe la prueba de CARDIO inCode®. De este grupo de población habrá una reducción adicional que al descrito anteriormente (0,7%).
Un beneficio indirecto de la intervención realizada con la consiguiente mejoría del riesgo cardiovascular será la reducción de los eventos cerebrovasculares isquémicos ya que la optimización de los factores de riesgo clásicos revierte beneficiosamente en la prevención de los casos de ictus.
Bibliografía:
1. Felix-Redondo FJ et al. Prevalencia, detección, tratamiento y grado de control de los factores de riesgo cardiovascular en la población de Extremadura (España). Estudio HERMEX. Aten Primaria. 2011;43:426-434.
2. Grau M et al. Cardiovascular risk factors in Spain in the first decade of the 21st Century, a pooled analysis with individual data from 11 population-based studies: the DARIOS study. Rev Esp Cardio 2011 Apr;64(4):295-304.
3. Plan Integral de Enfermedades Cardiovasculares 2017-2021: https://saludextremadura.ses.es/web/detalle-contenido-estructurado/plan-integral-de-enfermedades-cardiovasculares-de-extremadura?refMenu=350.
4. Fernandez-Bergés D. et al. Incidencia de cardiopatía isquémica en el estudio HERMEX y su asociación con los factores de riesgo cardiovascular clásicos. SEMERGEN. 2022;48:88-95.
5. Marrugat J et al. Validez relativa de la estimación del riesgo cardiovascular a 10 años en una cohorte poblacional del estudio REGICOR. Rev Esp Cardiol 2011; 64:385-9.
6. Elosua R et al. Estudio del componente genético de la cardiopatía isquémica: de los estudios de ligamiento al genotipado integral del genoma. Rev Esp Cardiol Supl 2009; 9:24B-38B
7. Roberts R. Genetic risk stratification. Tipping point for global primary prevention of coronary artery disease. Circulation 2018; 137:2554-2556.
8. Lluis-Ganella C et al. Assessment of the value of a genetic risk score in improving the estimation of coronary risk. Atherosclerosis 2012;222:456-463.
9. Iribarren C et al. Clinical utility of multimarker genetic risk scores for prediction of incident coronary heart disease. A cohort study among over 51,000 individuals of European ancestry. Circ Cardiovasc Genet 2016;9:531-540.
10. Iribarren C et al. Weighted multi-marker genetic risk scores for incident coronary heart disease among individuals of African, Latino and East-Asian Ancestry. Scientific Reports 2018;8:6853.
11. Ramirez de Arellano et al. Economic Evaluation of CARDIO inCode_, a Clinical-Genetic Function for Coronary Heart Disease Risk Assessment. Appl Health Econ Health Policy (2013) 11:531 542.
12. Driggin E et al. Cardiovascular considerations for patients, health care workers, and health systems during the coronavirus disease 2019 (COVID-19) pandemic. JACC 2020 April
13. Madjid M et al. Potential effects of coronaviruses on the cardiovascular system: A review. JAMA Cardiol 2020 March.
14. Villanueva et al . Evaluación poligénica integrada del riesgo cardiovascular y manejo clínico diferencial. Comunicación oral al Congreso Prevencionar 2021.
15. Félix-Redondo FJ, et al. Rendimiento de las funciones de riesgo cardiovascular propuestas para España en la población extremeña de la cohorte HERMEX. REC CardioClinics. 2019. https://doi.org/10.1016/j.rccl.2019.04.011
Listado de variables:
1) Sexo (1=Hombre, 2=Mujer).
2) Edad (años): Fecha de entrada estudio - Fecha nacimiento.
3) Fecha de visita basal (dd/mm/aaaa).
4) Peso (kg), con un decimal y talla (m) con dos decimales.
5) Índice de masa corporal (variable continua): Peso (Kg)/(Talla (m))2.
6) Consumo de tabaco (0=Nunca fumador; 1=Exfumador >1 año; 2=Fumador actual o exfumador< 1 año).
7) En fumadores y exfumadores <1 año, número de paquetes/año (variable continua).
8) Antecedentes de dislipemia (0=No; 1=Sí).
9) Colesterol total basal, a los 6 y a los 12 meses (variable continua).
10) Colesterol LDL basal, a los 6 y a los 12 meses (variable continua).
11) Colesterol HDL basal, a los 6 y a los 12 meses (variable continua).
12) Perfil hepático GOT, GPT, FA, GGT basal, a los 6 meses, a los 12 meses, si se cambia tratamiento farmacológico hipolipemiante o según criterios clínicos.
13) CPK a los 6 y 12 meses si se cambia tratamiento farmacológico hipolipemiante o según criterios clínicos.
14) Tipo de tratamiento hipolipemiante.
15) Antecedentes de hipertensión (0=No; 1=Sí).
16) Tipo de tratamiento para la hipertensión.
17) Presión arterial sistólica basal, a los 6 y a los 12 meses (variable continua).
18) Presión arterial diastólica basal, a los 6 y a los 12 meses (variable continua).
19) Antecedentes de diabetes (0=No; 1=Sí).
20) Tipo de tratamiento para la diabetes.
21) Glucemia basal, a los 6 y a los 12 meses (variable continua).
22) HbA1c (basal, a les 6 y a los 12 meses).
23) TFGe (basal, a les 6 y a los 12 meses).
24) Fecha de último seguimiento a los12 meses (dd/mm/aaaa).
25) Fármacos para la HTA (basal y final).
26) Fármacos para la dislipemia (basal y final).
27) Fármacos para la diabetes (basal y final).
28) Eventos sufridos durante seguimiento.
a. Angor (s/n) y fecha.
b. IAM (s/n) y fecha.
c. Ictus (s/n) y fecha.
i. Tipo (isq/hemorr).
d. Arteriopatia periférica sintomática.
e. Muerte CV (S/n) y fecha.
f. Muerte global (s/n) y fecha.
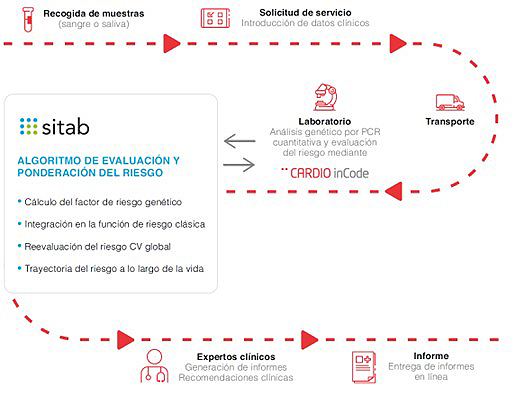
Anexo
Flujo de análisis de CARDIO inCode®
ANEXO 2
Actuaciones de las partes en relación con el Proyecto Piloto y el Producto
A) Gestiones a realizar por el SES durante la Fase de la Prueba Piloto para el análisis de las muestras de los pacientes con Cardio inCode®:
— Recogida de muestra (sangre) del paciente. Las muestras deberán cumplir con los requisitos mínimos para su procesamiento con el Producto y que GENINCODE remitirá por escrito al SES.
— Depósito en el punto centralizado de recogida de cada centro participante.
— Entrada de la petición Producto por parte del solicitante en la plataforma SITAB. Los datos del paciente son pseudonimizados a partir de esta fase. GENINCODE nunca dispone de datos identificativos relacionando la muestra con la identidad del paciente.
No obstante, de cara a agilizar y facilitar esta etapa para el personal sanitario involucrado en el Proyecto Piloto, GENINCODE ofrecerá el apoyo y soporte necesario (a convenir entre las partes) en la realización de esta tarea.
B) Servicios aportados por GENINCODE durante el Proyecto Piloto:
— Suministro del Producto para el número de pacientes incluidos en el Protocolo del Proyecto Piloto.
— Servicio logístico de recogida y envío de las muestras al laboratorio de GENINCODE.
— Procesamiento de las muestras en el laboratorio centralizado de GENINCODE.
— Elaboración de los informes individuales de pacientes.
— Elaboración de un informe global con el total de los pacientes incluidos en el Protocolo a los cuales se les haya analizado con el producto.
— Servicio automático de aviso de la disponibilidad del informe al médico solicitante, en un plazo aproximado de dos (2) semanas tras la recogida de la muestra.
— Soporte telefónico, por email y presencial por parte del equipo de GENINCODE sobre todos los aspectos relacionados con Proyecto Piloto que puedan ser requeridos: Científico, Clínico, Logístico, Laboratorio, Formación, etc.
Nota: Este texto carece de valor jurídico. Para consultar la versión oficial y auténtica puede acceder al fichero PDF del DOE.
Subir ^
Otras Opciones
2026 © Junta de Extremadura. Todos los derechos reservados
 Normativa ELI
Normativa ELI

 RSS
RSS
 Accesibilidad
Accesibilidad
 Mapa del sitio
Mapa del sitio
 Aviso Legal
Aviso Legal
 Normativa ELI
Normativa ELI

 Accesibilidad
Accesibilidad
 Mapa del sitio
Mapa del sitio
 Aviso Legal
Aviso Legal




