Junta de Extremadura
Página Web del Diario Oficial de Extremadura
Ultimos Diarios Oficiales
AVISO: La traducción a portugués deriva de un proceso automático con carácter informativo.Menú principal
Menú Derecha
Resolución de 31 de enero de 2023, de la Secretaría General, por la que se da publicidad al Convenio de Colaboración entre la Consejería para la Transición Ecológica y Sostenibilidad de la Junta de Extremadura y la Universidad de Extremadura para el estudio de las interacciones entre sustancias químicas tóxicas y la fauna extremeña, debido a la exposición a las mismas a través de cebos envenenados o por contaminación ambiental, como base de la gestión para la conservación de las especies y su hábitat. N.º Expte.: 2251999FR004.
DOE Número: 28
Tipo: Ordinario
Fecha Publicación: jueves, 09 de febrero de 2023
Apartado: III OTRAS RESOLUCIONES
Organismo: CONSEJERÍA DE HACIENDA Y ADMINISTRACIÓN PÚBLICA
Rango: ResoluciónDescriptores: Convenios. Página Inicio: 9003
Página Fin: 9040
Otros formatos:
TEXTO ORIGINAL
Habiéndose firmado el día 10 de noviembre de 2022, el Convenio de Colaboración entre la Consejería para la Transición Ecológica y Sostenibilidad de la Junta de Extremadura y la Universidad de Extremadura para el estudio de las interacciones entre sustancias químicas tóxicas y la fauna extremeña, debido a la exposición a las mismas a través de cebos envenenados o por contaminación ambiental, como base de la gestión para la conservación de las especies y su hábitat. N.º expediente: 2251999FR004, de conformidad con lo previsto en el artículo 8 del Decreto 217/2013, de 19 de noviembre, por el que se regula el Registro General de Convenios de la Administración de la Comunidad Autónoma de Extremadura,
RESUELVO:
La publicación en el Diario Oficial de Extremadura del convenio que figura como ANEXO de la presente resolución.
Mérida, 31 de enero de 2023.
La Secretaria General.
PA, Resolución de 01/03/2021,DOE n.º 43, de 4 de marzo de 2021.
La Jefa de Servicio de Legislación y Documentación,
M.ª MERCEDES ARGUETA MILLÁN

CONVENIO DE COLABORACIÓN ENTRE LA CONSEJERÍA PARA LA TRANSICIÓN ECOLÓGICA Y SOSTENIBILIDAD DE LA JUNTA DE EXTREMADURA Y LA UNIVERSIDAD DE EXTREMADURA PARA EL ESTUDIO DE LAS INTERACCIONES ENTRE SUSTANCIAS QUÍMICAS TÓXICAS Y LA FAUNA EXTREMEÑA, DEBIDO A LA EXPOSICIÓN A LAS MISMAS A TRAVÉS DE CEBOS ENVENENADOS O POR CONTAMINACIÓN AMBIENTAL, COMO BASE DE LA GESTIÓN PARA LA CONSERVACIÓN DE LAS ESPECIES Y SU HÁBITAT. N.º EXPEDIENTE: 2251999FR004
Mérida, 10 de noviembre de 2022.
REUNIDAS
De una parte, Dña. Consuelo Cerrato Caldera, Secretaria General para la Transición Ecológica y Sostenibilidad en virtud del Decreto 76/2019, de 16 de julio, por el que se dispone su nombramiento, y facultado para este acto por Resolución de la Excma. Sra. Consejera para la Transición Ecológica y Sostenibilidad de fecha 20 de noviembre de 2019, (DOE n.º 228, de 26 de noviembre de 2019) dictada conforme a lo previsto en los artículos 72 y 73 de la Ley 1/2002, de 28 de febrero del Gobierno y la Administración de la Comunidad Autónoma de Extremadura. El presente Convenio se celebra tras haber sido previamente autorizado por el Consejo de Gobierno de fecha 9 de noviembre de 2022 en virtud del artículo 43.3 de la Ley 3/2021, de 30 de diciembre, de presupuestos generales de la Comunidad Autónoma de Extremadura para el año 2022.
Y de otra, la Universidad de Extremadura, con CIF Q0618001B y sede en Badajoz, Avda. de Elvas, s/n, y en Cáceres, Plaza de los Caldereros, 1, y en su nombre y representación el Rector, D. Antonio Hidalgo García, nombrado por Decreto 2/2019, de 8 de enero (DOE n.º 6, de 10 de enero de 2019), con poderes suficientes, para la celebración de este acto, en virtud de lo establecido en el artículo 93 de los Estatutos de la citada Universidad, poderes que no le han sido derogados ni modificados.
Intervienen ambos en el ejercicio de las facultades que legalmente les confieren los cargos que respectivamente desempeñan, reconociéndose legitimación para la suscripción del presente Convenio de Colaboración y, al efecto,
EXPONEN
Primero. El Real Decreto 1997/1995, de 7 de diciembre, por el que se establecen medidas para contribuir a garantizar la biodiversidad mediante la conservación de los hábitats naturales y de la fauna y flora silvestres (BOE núm. 310, de 28 de diciembre de 1995) tiene como objetivo contribuir a garantizar la biodiversidad en el territorio en que se aplica la Directiva 92/43/CEE del Consejo, de 21 de mayo de 1992, relativa a la conservación de los hábitats naturales y de la fauna y flora silvestres (DOCE núm. 206, de 22 de julio de 1992), mediante la adopción de medidas para la conservación de los hábitats naturales y de la fauna y flora silvestres en el territorio español.


Las medidas que se adopten en virtud del referido Real Decreto tendrán como finalidad el mantenimiento o el restablecimiento, en un estado de conservación favorable, de los hábitats naturales y de las especies silvestres de la fauna y de la flora de interés comunitario en el territorio español y tendrán en cuenta las exigencias económicas, sociales y culturales, así como las particularidades regionales y locales.
Segundo. La Ley 42/2007, de 13 de diciembre, del Patrimonio Natural y de la Biodiversidad (BOE núm. 299, de 14 de diciembre de 2007) tiene como objeto establecer el régimen jurídico básico de la conservación, uso sostenible, mejora y restauración del patrimonio natural y de la biodiversidad, como parte del deber de conservar y del derecho a disfrutar de un medio ambiente adecuado para el desarrollo de la persona, establecido en el artículo 45.2 de la Constitución. En su artículo 54 se establece que las comunidades autónomas, en el ámbito de sus respectivas competencias, adoptarán las medidas necesarias para garantizar la conservación de la biodiversidad que vive en estado silvestre.
Tercero. Ley Orgánica 1/2011, de 28 de enero, de reforma del Estatuto de Autonomía de la Comunidad Autónoma de Extremadura (BOE núm. 25, de 29 de enero de 2011) establece en su artículo 10 que la Comunidad Autónoma de Extremadura tiene competencias de desarrollo normativo y ejecución en materia de medio ambiente, que incluye la regulación y protección de la flora, la fauna y la biodiversidad.
Asimismo, asume las competencias que le sean atribuidas, delegadas o transferidas por el Estado, de conformidad con lo previsto en la Constitución, y cualesquiera otras que le puedan corresponder de acuerdo con esta, con los otros títulos del presente Estatuto y con el resto del ordenamiento jurídico. En este sentido, el Real Decreto 1594/1984, de 8 de febrero, sobre transferencias en materia de conservación de la naturaleza de la Comunidad Autónoma de Extremadura (BOE núm. 219, de 12 de septiembre de 1984), en el marco legislación sobre protección del medio ambiente, y en lo que se refiere a la conservación de la naturaleza, transfiere a la Comunidad Autónoma de Extremadura las funciones relativas al establecimiento y ejecución de programas en materia de protección de especies amenazadas o en peligro de extinción y mantenimiento y reconstrucción de equilibrios biológicos en el espacio natural.


Cuarto. Por su parte, la Consejería para la Transición Ecológica y Sostenibilidad, tiene asumidas las competencias en materia de conservación de la naturaleza que le atribuyen los Reales Decretos de transferencias de funciones a la Junta de Extremadura, asignadas por el Excmo. Sr. Presidente de la Junta de Extremadura a la citada Consejería por Decreto del Presidente 41/2021, de 1 de julio (DOE núm. 126, de 2 de julio de 2019).
Conforme se establece en el Decreto 170/2019, de 29 de octubre, (DOE núm. 214, de 6 de noviembre de 2019), modificado por el Decreto 20/2021, de 31 de marzo (DOE núm. 64, de 7 de abril de 2022), entre los órganos directivos que constituyen la Consejería para la Transición Ecológica y Sostenibilidad se encuentra la Dirección General de Sostenibilidad, la cual llevará a cabo la promoción, ejecución y control en materia de conservación de la naturaleza y el medio ambiente. Asimismo, es competente en la programación y propuesta de actuaciones en relación con las áreas naturales protegidas y la biodiversidad. Para el cumplimiento de sus funciones, la DGS contará entre sus órganos administrativos con el Servicio de Conservación de la Naturaleza y Áreas Protegidas.
Quinto. La Comunidad Autónoma de Extremadura ha venido desarrollando diversas actuaciones tanto legislativas como ejecutivas, en materia de protección ambiental. Entre ellas se encuentra la promulgación de la Ley 8/1998, de 26 de junio, de conservación de la naturaleza y de espacios naturales de Extremadura (BOE núm. 200, de 21 de agosto de 1998), modificada por la Ley 9/2006, de 23 de diciembre (BOE núm. 24, de 27 de enero de 2007), que tiene como objeto el establecimiento de normas adicionales de protección del patrimonio natural de Extremadura, para facilitar su protección, conservación, restauración y mejora y asegurar su desarrollo sostenible y su preservación para las generaciones futuras.
Entre los objetivos perseguidos por esta Ley se encuentra el mantenimiento de los procesos ecológicos básicos, así como la biodiversidad y la singularidad y diversidad de los paisajes. Por ello, su artículo 57 establece que el mantenimiento y la preservación de la diversidad biológica del patrimonio natural y del patrimonio genético común se llevarán a cabo en el marco del establecimiento de figuras tanto de protección de hábitats naturales como de conservación, mantenimiento y recuperación de especies animales y vegetales. En este sentido, y entre otros, se considera como objetivo fundamental o criterio de protección dar preferencia a las medidas de conservación y preservación en el hábitat natural de cada especie, considerando la posibilidad de establecer medidas complementarias fuera del mismo.
Asimismo, mediante la aprobación del Catálogo Regional de Especies Amenazadas de Extremadura (DOE núm. 30, de 13 de marzo de 2001) se catalogaron aquellas especies de flora y fauna silvestres que requieren medidas específicas de protección, atendiendo a su rareza, singularidad, representatividad o excepcionalidad en Extremadura. Entre las especies incluidas en este registro público de carácter administrativo se encuentra el lince ibérico (Lynx pardinus), que cuenta con su Plan de Recuperación en Extremadura aprobado mediante Orden de 5 de mayo de 2016.


Sexto. En otro sentido, las sustancias químicas tóxicas pueden ejercer un efecto negativo sobre la fauna silvestre bien porque se usen en cebos envenenados (efectos agudos) o como residuos de los mismos tras baja exposición o por contaminación ambiental (efectos a largo plazo).
En la actualidad, el uso de cebos envenenados en el medio natural de Extremadura es un hecho constatado y constituye un grave problema para la protección y conservación de la fauna, afectando de manera significativa a las especies amenazadas y, en particular, a aves que consumen carroña habitual o esporádicamente.
Por ello, la Junta de Extremadura promulgó la Orden de 27 de marzo de 2015 por la que se aprueba la Estrategia Extremeña contra el uso ilegal de cebos envenenados en el medio natural (DOE, Núm. 66, de 8 de abril de 2015) que tiene como objetivo principal la erradicación del uso ilegal de cebos envenenados en el medio natural. Entre las cinco líneas principales de actuación de la mencionada Estrategia se encuentran la Acción 1 aumento y fluidez en el intercambio de información y mejora del conocimiento y la acción 3 investigación y persecución del delito , que incluyen entre sus actuaciones la realización de análisis toxicológicos.
Por otra parte, además del envenenamiento intencionado mediante el uso ilegal de cebos envenenados, también existen otras causas de envenenamiento no intencionado derivado del uso legal de ciertas sustancias tóxicas, principalmente fitosanitarios, que se emplean en la eliminación de especies que puedan afectar negativamente a la agricultura. Dentro de este grupo de sustancias destacan los rodenticidas anticoagulantes empleados en el control de las plagas de roedores, dado que la ingestión de animales fallecidos o expuestos a cebos envenenados con estas sustancias puede dar lugar a intoxicaciones secundarias o indirectas en sus predadores. En estos, además de los posibles efectos letales (muerte), los rodenticidas también pueden provocar efectos subletales como pueden ser modificaciones no letales en los parámetros de coagulación sanguínea, respuesta inflamatoria y fenómenos de supresión de la inmunidad, incrementando la vulnerabilidad a factores estresantes ambientales, como son las infecciones oportunistas (Fraser y col., 2018). Diversos estudios han comprobado que la exposición a rodenticidas por parte de fauna depredadora de roedores (ratas, ratones, conejo de monte ), incluyendo linces y rapaces, varía del 20 al 90% (Rached y col., 2020), estando este porcentaje fuertemente relacionado con la proximidad a áreas de actividad humana como áreas urbanas o granjas. Este hecho, la presencia de residuos de rodenticidas anticoagulantes en fauna depredadora de roedores, ha sido también puesta en evidencia en Extremadura en algunos análisis toxicológicos realizados a ejemplares de lince ibérico, gineta, zorro, búho real, águila imperial ibérica, águila real, milano real, milano negro, buitre leonado y buitre negro por parte del Grupo de Investigación en Toxicología de la Universidad de Extremadura, en su labor diagnóstica de envenenamientos animales.


En cualquier caso, todas las sustancias tóxicas colocadas en los cebos, incluyendo los rodenticidas, suponen un peligro para la biodiversidad de los ecosistemas, y Extremadura se caracteriza por ser una región con una biodiversidad faunística de primer orden. Por este motivo, los análisis toxicológicos no sólo deben limitarse a la identificación de las sustancias tóxicas habitualmente empleadas para el envenenamiento ilegal de la fauna, sino que también debe utilizarse para detectar otros tóxicos no convencionales que evidencien un riesgo creciente para la fauna, como son los rodenticidas anticoagulantes.
Por ello, se hace necesario estudiar los efectos del uso ilegal de cebos envenenados en las especies silvestres en el medio natural en Extremadura, así como de otras fuentes de envenenamiento no intencionado de fauna como el uso legal de rodenticidas, destacando los casos de algunas especies muy relevantes como es el lince ibérico.
Este estudio resulta imprescindible para elaborar, actualizar y desarrollar las herramientas de ordenación, planificación y gestión de los terrenos incluidos en la Red Natura 2000 y otras zonas de alto valor natural de la Comunidad Autónoma de Extremadura; así como para elaborar y desarrollar las herramientas de conservación de las especies amenazadas y otros valores naturales que motivaron la declaración de espacios de la Red Natura 2000 y otras zonas de alto valor natural.
Séptimo. El lince ibérico está considerado actualmente por la Unión Mundial para la Conservación de la Naturaleza (en adelante, UICN) como el felino más amenazado del mundo. Es también considerado el carnívoro más amenazado de Europa. El área de distribución actual se restringe al Sudoeste de la Península Ibérica, con el 98% de la población en territorio español.
La situación crítica del lince ibérico es suficientemente reconocida internacionalmente. Así, la UICN cambió su clasificación en el año 2002 de En peligro de extinción a la categoría de En peligro crítico de extinción . Tras seis decenios de declive, la población del lince ibérico pasó de 52 individuos maduros en 2002 a 156 en 2012, por lo que la especie pasó nuevamente en 2015 a la categoría “En Peligro”, resultado que se logró mediante acciones intensivas de conservación. En el ámbito de la Comunidad autónoma de Extremadura, se considera una especie protegida, teniendo la categoría de “en peligro de extinción” en el Catálogo Regional de Especies Amenazadas de Extremadura.


Los análisis realizados por la Universidad de Extremadura con la metodología química-analítica más sofisticada están demostrando la presencia de residuos subletales de rodenticidas anticoagulantes en hígados de linces ibéricos, qué si bien no matarían, sí podrían producir efectos indirectos, como la aparición de infecciones oportunistas. Esto ha sido comprobado especialmente en el caso de la sarna notoédrica que ha precipitado el declive poblacional del lince rojo norteamericano en algunas regiones, e incluso diezmado en algunos focos, de California (Serieys et al. 2013, 2015, 2018). La mortalidad asociada a la sarna mostró una fuerte asociación con la exposición a rodenticidas, particularmente con residuos en hígado mayores a 50 ppb, si bien otros linces que tuvieron niveles similares murieron por otras causas (Riley et al. 2007). En un estudio posterior (Serieys et al. 2013) en linces rojos muertos por sarna se encontraron niveles medios de 230 ppb de brodifacum y 620 ppb de bromadiolona.
Según su dieta, los depredadores pueden sufrir exposiciones secundarias a rodenticidas anticoagulantes tanto de especies diana como no diana. El lince es un carnívoro especialista en la caza del conejo de monte que puede llegar a suponer más del 80% de su dieta, siendo esta especie casi la exclusiva en algunas zonas y épocas del año. Actualmente se desconoce la incidencia que puede tener la presencia de rodenticidas anticoagulantes en conejos, por lo que sería importante conocerla.
Por los motivos expuestos, el estudio de la exposición a rodenticidas anticoagulantes en las especies silvestres toma especial relevancia en las áreas de presencia estable y dispersión del lince ibérico en Extremadura.
Octavo. La Universidad de Extremadura es una Institución de Derecho Público encargada del servicio público de la educación superior, con personalidad jurídica y patrimonio propios e independientes de los del Estado la Comunidad Autónoma de Extremadura y otros Entes Públicos. Como tal, desarrolla sus funciones en régimen de autonomía y de coordinación con las demás instituciones y asume los fines y competencias que le otorgan, entre otros, sus Estatutos aprobados mediante Decreto 65/2003, de 8 de mayo (DOE 3, de 23 de mayo de 2003).
Entre los fines de la Universidad de Extremadura se encuentran la creación, el desarrollo y transmisión crítica de la ciencia, de la técnica y tecnología, de las ciencias humanas y sociales; la difusión, la valoración y la transferencia del conocimiento al servicio de la cultura, de la calidad de vida y del desarrollo económico; la difusión del conocimiento y de la cultura mediante la extensión universitaria y la formación permanente; el apoyo científico y técnico al desarrollo social, económico y cultural, así como el mejor conocimiento en todos sus aspectos de la Comunidad Autónoma de Extremadura; la cooperación para el desarrollo, y el intercambio científico, técnico y artístico con otras instituciones y entidades tanto españolas como extranjeras; y la conservación, incremento y difusión de su patrimonio artístico, científico, técnico, documental e inmobiliario.


Para el cumplimiento de sus fines la Universidad de Extremadura, en el ejercicio de su autonomía, dispondrá necesariamente, y sin otras limitaciones que las que le sean impuestas por las leyes, de competencias entre las que se encuentran: la creación, modificación y supresión de estructuras que actúen como soporte de la investigación; el establecimiento de relaciones de cooperación con otras entidades e instituciones académicas, culturales o científicas españolas y de cualquier otra parte del mundo, teniendo en cuenta la especial relevancia en Extremadura de los vínculos con Portugal y la Comunidad Iberoamericana; el establecimiento de relaciones y convenios de colaboración con cualesquiera otras entidades públicas o privadas; así como cualesquiera otras competencias necesarias para el adecuado cumplimiento de sus fines que no hayan sido reservadas al Estado o a la Comunidad Autónoma de Extremadura en la legislación vigente.
Noveno. La Universidad de Extremadura dispone en su Facultad Veterinaria de Cáceres de personal y equipamiento especializado en el campo de la toxicología.
En este sentido, dispone de una Unidad de Toxicología, que a través del Grupo de Investigación en Toxicología (referencia CTS010 del catálogo de grupos de investigación de la Junta de Extremadura), desarrolla diversas líneas de trabajo aplicadas a los variados campos que engloba la Toxicología, entre las que se encuentra la identificación de procesos toxicológicos que afecten al medio ambiente a través del análisis de muestras de fauna salvaje y cebos sospechosos presentes en el medio.
La Unidad está compuesta por profesores de Universidad con amplia experiencia en investigación y docencia en el área de Toxicología, así como por Técnicos de Laboratorio con gran experiencia en la realización de análisis toxicológicos. Así, el referido grupo de investigación participa en diferentes publicaciones que constatan el uso de cebos envenenados en el medio natural en Extremadura y el peligro que suponen para su fauna:
— F. Soler, A.L. Oropesa y M. Pérez (2006). Análisis de los envenenamientos en fauna silvestre. Situación en Extremadura. Revista de Toxicología 23(1): 35-38.
— M. Martínez-Haro, R. Mateo, R. Guitart, F. Soler, M. Pérez-López, P. María-Mojica y A.J. García-Fernández (2008). Relationship of the toxicity of pesticide formulations and their commercial restrictions with the frequency of animal poisonings. Ecotoxicology and Environmental Safety 69:396-402.


— Y Ibáñez-Pernía, D. Hernández-Moreno, M. Pérez-López, F. Soler-Rodríguez (2022). Use of poisoned baits against wildlife. A retrospective 17-year study in the natural environment of Extremadura (Spain) Environmental Pollution 303: 119098.
La Unidad de Toxicología dispone de un Laboratorio de Diagnóstico Toxicológico que tiene como misión el estudio y análisis toxicológico de muestras y casos remitidos por particulares, veterinarios clínicos, empresas o instituciones, y desde su creación en el año 1997, está integrado en el Servicio de Hospital Clínico Veterinario de la Universidad de Extremadura. En los últimos años ha analizado más de 2.300 casos de envenenamiento en animales. Asimismo, dispone de laboratorio específico para análisis de cebos y muestras de animales envenenados con vitrinas de gases y equipos instrumentales para la extracción y purificación de tóxicos orgánicos con solventes. Esta labor inicial se complementa con laboratorios de instrumentación analítica de última generación pertenecientes a los Servicios de Apoyo a la Investigación de la Universidad de Extremadura (http://saiuex.unex.es/), entre los que se encuentran el Servicio de análisis e innovación en alimentos de origen animal y el Servicio de Análisis Elemental y Molecular, que cuenta con distintos equipos instrumentales de última tecnología. Así, en el SIPA se dispone de cromatógrafo de gases con detector de MS/MS (45-GC-Scion Triple Quadrupole detector de Bruker®), cromatógrafo de líquidos con detector MS/MS (Agilent® 6470 Triple Quadrupole LC/MS) y cromatógrafo de líquidos con detector MS/QTOF (HPLC 1260 QTOF 6550 de Agilent®) que permite el análisis de cualquier compuesto tóxico de naturaleza orgánica (como insecticidas, raticidas y otros numerosos plaguicidas y contaminantes). Igualmente, se dispone de un horno microondas automatizado para la digestión ácida controlada de las muestras, sobre las que se analizarán compuestos inorgánicos (plomo, mercurio, arsénico ) utilizando un equipo de polarografía Methrom® y un ICP-MS (NexION 300D con automuestreador de PerkinElmer®) que permiten el análisis simultáneo de diversos elementos químicos.
El Servicio de análisis e innovación en alimentos de origen animal (SiPA) focaliza sus actividades en los productos de origen animal. Su objetivo es poner en valor el conocimiento científico-técnico adquirido de investigaciones en el sector de los alimentos de origen animal, a través de una infraestructura singular avanzada para prestar servicios de análisis e innovación a investigadores de la UEx, OPIs y al sector. El SiPA se encuentra ubicado el Edifico de Institutos Universitarios del campus universitario de Cáceres.
Por otra parte, el Servicio de Análisis Elemental y Molecular (SAEM) ha sido diseñado para dar respuesta y apoyo a aquellos problemas analíticos y de determinación estructural que puedan surgir a los investigadores dentro de la labor que realizan, teniendo también como objetivo prestar servicio tanto a organismos públicos como a empresas privadas. Para ello el servicio cuenta con una serie de unidades en las que se dispone de técnicas instrumentales de análisis y determinación estructural mediante las cuales es posible abarcar un amplio campo en análisis químico, desarrollo de métodos analíticos y caracterización e identificación de compuestos. El SAEM se encuentra ubicado en el Edificio Servicios de Apoyo a la Investigación del campus universitario de Badajoz.


Décimo. El presente Convenio se cofinancia en un 80% mediante la submedida 7.1. Elaboración, actualización de planes de protección y gestión de zonas de Red Natura 2000 y zonas de alto valor natural del Programa de Desarrollo Rural de Extremadura 2014-2022 (FEADER, Europa invierte en las zonas rurales) al incluir actuaciones consistentes en estudios para la mejora en el conocimiento de las especies protegidas, así como para elaborar, actualizar y desarrollar las herramientas de ordenación, planificación y gestión de los terrenos incluidos en la Red Natura 2000 y otras zonas de alto valor natural de la Comunidad Autónoma de Extremadura; y elaborar y desarrollar las herramientas de conservación de las especies amenazadas y otros valores naturales que motivaron la declaración de espacios de la Red Natura 2000 y otras zonas de alto valor natural.
Décimo primero. Con fecha 19 de diciembre de 2020 se firmó el Convenio entre la Consejería para la Transición Ecológica y Sostenibilidad de la Junta de Extremadura y la Universidad de Extremadura para la Determinación de procesos toxicológicos en la fauna silvestre en Extremadura. Anualidades 2020-2021-2022 , con fecha de finalización 31 de diciembre de 2022.
Tras finalizar las actuaciones previstas en dicho Convenio se ha constatado la necesidad de efectuar un estudio de las interacciones entre sustancias químicas tóxicas y la fauna extremeña, debido a la exposición a las mismas a través de cebos envenenados o por contaminación ambiental, como base de la gestión para la conservación de las especies y su hábitat durante las anualidades 2023 y 2024, motivo por el cual se suscribe el presente Convenio.
Por cuanto antecede, es voluntad de las partes suscribir un Convenio que defina la colaboración entre las mismas a los fines que a continuación se describen, a cuyo efecto, otorgan el presente documento en virtud de las siguientes,
CLÁUSULAS
Primera. Objeto.
El objeto general del presente Convenio es establecer la colaboración entre las partes para mejorar el conocimiento científico sobre el estado de conservación de la fauna en Extremadura y, en especial, de las especies amenazadas, como base de la gestión para la conservación de estas especies y su hábitat, mediante la elaboración de un estudio de las interacciones entre sustancias químicas tóxicas y la fauna extremeña, debido a la exposición a las mismas a través de cebos envenenados o por contaminación ambiental.


Este estudio incluirá y analizará los datos obtenidos de los diferentes análisis toxicológicos realizados, el tratamiento de los resultados obtenidos y la elaboración de conclusiones en base a los mismos. Estas conclusiones servirán como base de mejora de la Estrategia Extremeña contra el uso ilegal de cebos envenenados en el medio natural, resultando imprescindibles para elaborar, actualizar y desarrollar las herramientas de ordenación, planificación y gestión de los terrenos incluidos en la Red Natura 2000 y otras zonas de alto valor natural de la Comunidad Autónoma de Extremadura; así como para elaborar y desarrollar las herramientas de conservación de las especies amenazadas y otros valores naturales que motivaron la declaración de espacios de la Red Natura 2000 y otras zonas de alto valor natural.
Asimismo, permitirá ampliar la información y conocimiento disponible sobre el uso de venenos en Extremadura, servir como base para el desarrollo y ejecución de operativos específicos encaminados a la prevención y disuasión y, finalmente, proporcionar apoyo a la investigación y persecución del delito.
Segunda. Actuaciones.
El presente Convenio, y para la elaboración del Estudio indicado en la cláusula primera, contempla la realización de los siguientes análisis:
— Análisis toxicológicos de intoxicaciones directas por cebos envenenados (efectos agudos) en muestras biológicas de fauna extremeña.
— Análisis toxicológicos de intoxicaciones indirectas por residuos de cebos envenenados o por contaminación ambiental (efectos a largo plazo) en muestras biológicas de fauna extremeña.
Tercera. Obligaciones y compromisos de las partes.
La Consejería para la Transición Ecológica y Sostenibilidad de la Junta de Extremadura, a través de la Dirección General de Sostenibilidad, se compromete a:
— Realizar muestreos de campo para la recogida de muestras biológicas conforme a las directrices establecidas en el Anexo Técnico. Estas tareas serán realizadas mediante medios humanos y materiales existentes en el Servicio de la Conservación de la Naturaleza y Áreas Protegidas de la Dirección General de Sostenibilidad, no generando un gasto adicional para la administración regional. No obstante, la Dirección General de Sostenibilidad podrá requerir a la Universidad de Extremadura la presencia de personal del Grupo de investigación en Toxicología (CTS010) aquellas tomas de muestras en campo que impliquen conocimientos técnicos especiales en toxicología.


— Aportar la cantidad de ochenta mil ochocientos euros (80.800,00 €) a la Universidad de Extremadura destinados a financiar los gastos derivados de la realización de las actuaciones contenidas en la cláusula segunda.
La Universidad de Extremadura, a través del Grupo de investigación en Toxicología (CTS010), se compromete a:
— Recepcionar, custodiar y analizar las muestras entregadas por el Servicio de Conservación de la Naturaleza y Áreas Protegidas de la Dirección General de Sostenibilidad, desarrollando las actuaciones referidas en la cláusula segunda conforme se estable en el Anexo Técnico del Convenio. Por ello también será responsable del adecuado envío de las muestras a los Servicios de Apoyo a la Investigación de la Universidad de Extremadura (SAIUEx), SiPA en Cáceres y SAEM en Badajoz, para la realización de aquellos análisis que se consideren necesarios para la realización de las actuaciones contenidas en la cláusula segunda.
— Colaborar, a requerimiento de la Dirección General de Sostenibilidad de la Junta de Extremadura, en aquellas tomas de muestras en campo que impliquen conocimientos técnicos especiales en toxicología.
— Destinar los fondos aportados por la Consejería para la Transición Ecológica y Sostenibilidad de la Junta de Extremadura para sufragar los gastos derivados de las actuaciones descritas en la cláusula segunda. Para ello, aportarán para el desarrollo del Convenio las instalaciones, los materiales y equipos, así como el personal necesario para el correcto desarrollo de las actuaciones previstas.
— Justificar las cantidades recibidas de la Consejería para la Transición Ecológica y Sostenibilidad y presentar las Memorias de las actuaciones realizadas conforme se establece en la Cláusula Cuarta del Convenio.
En este sentido, los contratos que pudiera celebrar la Universidad de Extremadura con terceros para la ejecución de las actuaciones objeto de este Convenio serán de su exclusiva responsabilidad, efectuándose a su riesgo y ventura. Así mismo, si la Universidad de Extremadura contratara personal para la ejecución del presente Convenio, con cargo al mismo, dicho personal no tendrá relación laboral alguna con la Junta de Extremadura.


Cuarta. Forma de pago.
La aportación especificada en la cláusula tercera de la Consejería para la Transición Ecológica y Sostenibilidad se realizará de la siguiente forma:
1. El abono de las cantidades convenidas se realizará mediante certificaciones parciales y finales conforme al desglose económico y de anualidades establecido en el apartado 6 del Anexo Técnico.
2. Para cada certificación la Universidad de Extremadura entregará a la Consejería para la Transición Ecológica y Sostenibilidad una acreditación de las actuaciones realizadas consistente en una (1) memoria del estudio establecido conforme a las cláusulas primera y segunda, y que se concretan en lo siguiente:
— Estudio de las interacciones entre sustancias químicas tóxicas y la fauna extremeña, debido a la exposición a las mismas a través de cebos envenenados o por contaminación ambiental, que deberá venir firmado por el catedrático Francisco Soler Rodríguez como miembro del Grupo de investigación en Toxicología (CTS010). Este estudio se realizará en base a las muestras y datos disponibles hasta la fecha de su elaboración.
Las certificaciones parciales incluirán las memorias intermedias del estudio y la certificación final la memoria final del estudio.
3. Posteriormente las certificaciones serán firmadas por el Director/a Técnico/a del Convenio nombrado en virtud de la cláusula décima, por los trabajos ejecutados conforme al Anexo Técnico, y una vez justificados los gastos y pagos que se efectúen con cargo al Convenio, procediéndose a los pagos que se realizarán de la siguiente forma:
— Un primer pago correspondiente a la cantidad de 42.800,00 €, a tramitar antes del 15 de noviembre de 2023, previa certificación parcial.
— Un segundo y último pago correspondiente a la cantidad de 38.000,00 € una vez finalizados los trabajos o, en todo caso, a la finalización del Convenio, previa certificación final.
4. Los pagos se realizarán mediante transferencia bancaria a la cuenta corriente IBAN ES39 0049-6744-45-2216163524 del Banco de Santander a nombre de la Universidad de Extremadura, indicando como referencia el título de este convenio.


Quinta. Financiación.
El coste total del presente Convenio de colaboración que asciende a ochenta mil ochocientos euros (80.800,00 €), se financiarán con cargo a:
| Anualidad | Centro gestor | Posición | Fondo | Proyecto | Importe |
|---|---|---|---|---|---|
| 2023 | 180030000 | G/354A/64100 | FR14070100 | 20160218 | 42.800,00 € |
| 2024 | 180030000 | G/354A/64100 | FR14070100 | 20160218 | 38.000,00 € |
| TOTAL | 80.800,00 € |
Los gastos derivados de la realización de las actuaciones incluidas en el presente Convenio de Colaboración son elegibles y subvencionables y se encuentran cofinanciados con fondos FEADER (Europa invierte en las zonas rurales) del Programa de Desarrollo Rural de Extremadura 2014-2022, con una tasa de financiación del 80%, y están comprendidos en:
Submedida 7.1. Elaboración, actualización de planes de protección y gestión de zonas de Red Natura 2000 y zonas de alto valor natural , conforme a la ficha de elegibilidad que se adjunta, en el marco de la normativa europea y nacional aplicable, en particular, el Reglamento (UE) N.º 1303/2013 del Parlamento Europeo y del Consejo de 17 de diciembre de 2013, el Reglamento (UE) N.º 1305/2013 del Parlamento Europeo y del Consejo de 17 de diciembre de 2013, el Reglamento Delegado (UE) N.º 807/2014 de la Comisión de 11 de marzo de 2014, el Reglamento de ejecución (UE) N.º 808/2014 de la Comisión de 17 de julio de 2014 y el Reglamento Delegado (UE) 2015/1367 de la Comisión de 4 de junio de 2015.
En el presente convenio se seguirá el procedimiento de tramitación anticipada previsto en la regla 69 de la Orden 17 de diciembre de 2020, por la que se aprueba la instrucción de operatoria contable a seguir en la ejecución del gasto de la Administración de la Comunidad Autónoma de Extremadura.
El presente expediente queda sometido a la condición suspensiva de existencia de crédito adecuado y suficiente en el ejercicio presupuestario en el que se ejecutará.
Sexta. Propiedad intelectual.
La propiedad intelectual de los trabajos realizados, así como de las muestras biológicas necesarias para ello, corresponde a la Universidad de Extremadura y a la Consejería para la Transición Ecológica y Sostenibilidad dentro de los términos establecidos en el Real Decreto Legislativo 1/1996, de 12 de abril, por el que se aprueba el texto refundido de la Ley de Propiedad Intelectual, regularizando, aclarando y armonizando las disposiciones legales vigentes sobre la materia (BOE núm. 97, de 22 de abril de 1996).


No se permitirá la reproducción total de los trabajos ni su tratamiento informático, ni la transmisión por cualquier medio, ya sea electrónico, mecánico, por fotocopia, por registro u otros métodos, sin el permiso previo y por escrito de la Consejería para la Transición Ecológica y Sostenibilidad de la Junta de Extremadura y de la Universidad de Extremadura, asimismo se incorporarán los logotipos de la Junta de Extremadura, la Universidad de Extremadura y del Fondo Europeo Agrícola de Desarrollo Rural FEADER.
Séptima. Confidencialidad y protección de datos.
La Consejería para la Transición Ecológica y Sostenibilidad y la Universidad de Extremadura se comprometen a preservar la confidencialidad de cualquier documento, información u otro material que se produzca o a la que se tenga acceso como resultado de la ejecución de las actividades realizadas en el marco del presente Convenio. Cada una de las partes se compromete, por tanto, a no difundir, sin el consentimiento de la otra parte, las informaciones científicas o técnicas pertenecientes a la otra parte, a las que haya podido tener acceso con ocasión del desarrollo de las actuaciones objeto del Convenio, salvo que esas informaciones sean del dominio público o que la revelación de las mismas sea requerida por ley.
El tratamiento de datos de carácter personal será conforme a las previsiones contenidas en la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales. Con carácter general, durante la ejecución del Convenio, ha de procurarse la debida protección de los datos de carácter personal, debiendo estarse a lo dispuesto, en primer lugar, en el Reglamento (UE) 2016/679 del Parlamento Europeo y del Consejo de 27 de abril de 2016 relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y por el que se deroga la directiva 95/46/CE (Reglamento General de Protección de Datos o RGPD) y asimismo a lo dispuesto en la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales y en la restante normativa aplicable en la materia, siendo recomendable que la documentación que se proporcione para el desarrollo de las mismas contenga datos disociados (artículo 5,1,e) y p) del RD 1720/2007, de 21 de diciembre), cuando ello sea posible.
Octava. Vigencia del convenio.
La duración de este Convenio se fija en dos años a partir del 1 de enero de 2023. No obstante, de conformidad con lo dispuesto en el artículo 49.h) de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, las partes podrán acordar de mutuo acuerdo su prórroga por un periodo de hasta cuatro años adicionales o su extinción mediante la firma de una adenda al mismo, la cual deberá suscribirse antes de la finalización del plazo de vigencia del Convenio. En caso necesario, y de mutuo acuerdo en el seno de la Comisión de Seguimiento constituida según cláusula décima del presente Convenio, y siempre de forma expresa, la ampliación de plazo de vigencia del Convenio podrá llevar aparejada la ampliación de su presupuesto.


Novena. Modificación, extinción y resolución.
El Convenio podrá ser modificado por mutuo acuerdo de las partes. Se extinguirá por el cumplimiento de las actuaciones que constituyen su objeto, o por incurrir en causa de resolución. Serán causas de resolución las previstas en el artículo 51 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, y en particular:
a) El vencimiento del plazo de vigencia.
b) El acuerdo unánime de las partes.
c) Por incumplimiento de las obligaciones y compromisos asumidos por parte de alguno de los firmantes. En este caso, cualquiera de las partes podrá notificar a la parte incumplidora un requerimiento para que cumpla en un determinado plazo con las obligaciones o compromisos que se consideran incumplidos. Este requerimiento será comunicado al responsable del mecanismo de seguimiento, vigilancia y control de la ejecución del convenio y a las demás partes firmantes.
Si trascurrido el plazo indicado en el requerimiento persistiera el incumplimiento, la parte que lo dirigió notificará a las partes firmantes la concurrencia de la causa de resolución y se entenderá resuelto el convenio. La resolución del convenio por esta causa dará lugar al reintegro de las cantidades que se hubiese recibido, así como los intereses legales que hubieran devengado las citadas cantidades.
Décima. Comisión de seguimiento.
De acuerdo con lo establecido en el artículo 49.f de la de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, se constituye una Comisión de seguimiento de composición mixta para el seguimiento, vigilancia y control del presente Convenio, evaluando su aplicación, garantizando su calidad y promoviendo las líneas de seguimiento, control e investigación, así como aquellas actuaciones de coordinación que se consideren necesarias.


La Comisión estará formada por un representante de cada una de las entidades firmantes:
— Por parte de la Consejería para la Transición Ecológica y Sostenibilidad su Directora de Programas de Conservación, María Jesús Palacios González, que ejercerá las funciones de Director Técnico del Convenio o en su caso la persona en quien delegue el Director General de Sostenibilidad.
— y por parte de la Universidad de Extremadura por el catedrático Francisco Soler Rodríguez como miembro del Grupo de investigación en Toxicología (CTS010), pudiendo delegar su representación en Marcos Pérez López, profesor titular de la Universidad de Extremadura y miembro del referido Grupo de Investigación.
Dicha Comisión se constituirá en el plazo de treinta días, contados a partir de la fecha de la firma del presente Convenio. Esta Comisión se reunirá, al menos, una vez durante el plazo de vigencia del Convenio.
Tanto la convocatoria de las sesiones que celebren como el funcionamiento interno y la adopción de acuerdos se regirán con arreglo al procedimiento general de actuación de los órganos colegiados que contempla el artículo 15 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
Décima primera. Información y publicidad.
El presente convenio está cofinanciado por el Fondo Europeo Agrícola de Desarrollo Rural por lo que la Universidad de Extremadura se compromete a dar adecuada publicidad del carácter público de la financiación objeto de subvención, teniendo en cuenta las consideraciones de información y publicidad previstas en el artículo 66 del Reglamento (UE) n.º 1305/2013, del Parlamento Europeo y del Consejo de 17 de diciembre de 2013, relativo a la ayuda al desarrollo rural a través del Fondo Europeo Agrícola de Desarrollo Rural (FEADER) y por el que se deroga el Reglamento (CE) N.º 1698/2005, del Consejo y el Anexo III del Reglamento (UE) n.º 808/2014, de la Comisión de 17 de julio de 2014, por el que se establecen las disposiciones de aplicación del Reglamento anterior, Asimismo, se compromete a adoptar las medidas de identificación, información y publicidad reguladas en el artículo 3 del Decreto 50/2001, de 3 de abril, sobre medidas adicionales de gestión de inversiones financiadas con ayudas de la Junta de Extremadura.
En este sentido, los informes de resultados de los análisis, así como los estudios derivados del Convenio realizados deberán incluir el logotipo FEADER (Europa invierte en las zonas rurales), el logotipo de la Junta de Extremadura y el logotipo de la Universidad de Extremadura.


Décima segunda. Régimen jurídico e interpretación.
El presente Convenio tiene naturaleza administrativa y se encuadra en el tipo establecido en el artículo 47.d) de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, siéndole aplicable el régimen jurídico contenido en dicha Ley.
Las discrepancias, así como, las controversias sobre la interpretación y ejecución del presente Convenio de colaboración y las cuestiones litigiosas a las que pueda dar lugar la interpretación, modificación, efectos o resolución del presente Convenio, y que no sean resueltas en el seno de la Comisión de Seguimiento previstas en la cláusula novena, quedarán sometidas al conocimiento y resolución de la Jurisdicción Contencioso-Administrativa, de conformidad con la Ley 29/1998, de 13 de julio, reguladora de dicha jurisdicción, una vez agotada la vía de la Comisión de Seguimiento prevista en el mismo.
En prueba de conformidad, las partes firman el presente Convenio de Colaboración por duplicado ejemplar y a un solo efecto en lugar y fecha indicados en el encabezamiento.
La Consejera para la Transición Ecológica y Sostenibilidad.
PA, (Resolución de 20 de noviembre de 2019, de la Consejera, DOE n.º 228, de 26 de noviembre de 2019).
La Secretaria General,
CONSUELO CERRATO CALDERA
El Rector Magnífico de La Universidad de Extremadura,
ANTONIO HIDALGO GARCÍA


ANEXO TÉCNICO
ESTUDIO DE LAS INTERACCIONES ENTRE SUSTANCIAS QUÍMICAS TÓXICAS Y LA FAUNA EXTREMEÑA, DEBIDO A LA EXPOSICIÓN A LAS MISMAS A TRAVÉS DE CEBOS ENVENENADOS O POR CONTAMINACIÓN AMBIENTAL
1. Objeto.
El estudio tiene como objetivo general la generación de conocimiento científico respecto a las consecuencias del uso de sustancias químicas tóxicas sobre la fauna silvestre extremeña como base para la gestión y conservación de la biodiversidad.
Como objetivos específicos, el estudio persigue la generación de conocimiento científico sobre:
— El uso de cebos envenenados en el medio natural y su incidencia en las diversas especies animales afectadas.
— El uso de rodenticidas anticoagulantes sobre fauna silvestre protegida, haciendo especial énfasis en las áreas de presencia del lince ibérico (Lynx pardinus).
Para la consecución de estos objetivos se realizarán análisis toxicológicos de intoxicaciones directas por cebos envenenados (efectos agudos) y de intoxicaciones indirectas por residuos de cebos envenenados o por contaminación ambiental (efectos a largo plazo) en muestras biológicas de fauna sospechosas de envenenamiento.
Este estudio incluirá y analizará los datos obtenidos de los diferentes análisis toxicológicos realizados, el tratamiento de los resultados obtenidos y la elaboración de conclusiones en base a los mismos. Estas conclusiones servirán como base de mejora de la Estrategia Extremeña contra el uso ilegal de cebos envenenados en el medio natural, resultando imprescindibles para elaborar, actualizar y desarrollar las herramientas de ordenación, planificación y gestión de los terrenos incluidos en la Red Natura 2000 y otras zonas de alto valor natural de la Comunidad Autónoma de Extremadura; así como para elaborar y desarrollar las herramientas de conservación de las especies amenazadas y otros valores naturales que motivaron la declaración de espacios de la Red Natura 2000 y otras zonas de alto valor natural.
Asimismo, permitirá ampliar la información y conocimiento disponible sobre el uso de venenos en Extremadura, servir como base para el desarrollo y ejecución de operativos específicos encaminados a la prevención y disuasión y, finalmente, proporcionar apoyo a la investigación y persecución del delito.


2. Compuestos a Analizar: Relación y Metodología.
2.1. Elementos Químicos Inorgánicos (Metales).
Se analizarán en las muestras de sangre e hígado los siguientes elementos tóxicos y contaminantes: plomo (Pb), cadmio (Cd), mercurio (Hg), arsénico (As) y selenio (Se) siguiendo los métodos descritos por De la Casa et al (2014) y Neila et al (2017), respectivamente.
Para cada muestra se procederá a una digestión ácida inicial con ácido nítrico (HNO3) y peróxido de hidrógeno (H2O2) en proporción 3:1 en un horno microondas automatizado para la digestión controlada de las muestras. Sobre el extracto digerido se analizarán los elementos indicados utilizando un equipo de polarografía Methrom® y un equipo de ICP-MS (NexION 300D con automuestreador de PerkinElmer®) que permiten el análisis simultáneo de los diversos elementos químicos. Como control de calidad de la metodología se analizarán blancos de reactivos y una solución control certificada por cada lote de 10 muestras.
Bibliografía:
De la Casa-Resino I., D. Hernández-Moreno, A. Castellano, M. Pérez-López y F. Soler. 2014. Breeding near a landfill may influence blood metals (Cd, Pb, Hg, Fe, Zn) and metalloids (Se, As) in white stork (Ciconia ciconia) nestlings. Ecotoxicology 23:1377 1386.
Neila C, Hernández-Moreno D, Fidalgo LE, López-Beceiro A, F. Soler y M. Pérez-López. 2017. Does gender influence the levels of heavy metals in liver of wild boar? Ecotoxicology and Environmental Safety 140: 24-29.
2.2. Plaguicidas organoclorados, organofosforados, piretroides, fungicidas y otros (método multirresiduo).
Se utilizará la metodología QuEChERS adaptada a contenido digestivo, posibles cebos envenenados y tejidos orgánicos de animales consistente básicamente en una homogeneización de la muestra con agua destilada, extracción con un solvente orgánico (acetonitrilo), separación de la fase orgánica con mezcla de sales, y posterior purificación del extracto con distintos sorbentes (C18, PSA y sulfato de magnesio).
Sobre el extracto final se analizarán un total de 192 plaguicidas usando un equipo de cromatografía de gases con detector de MS/MS (45-GC-Scion Triple Quadrupole detector de Bruker®) con columna capilar de SLB-5ms de Supelco (30 m × 0.25 mm, df 0.25 m) y automuestreador. Como control de calidad de la metodología se analizarán blancos de reactivos y adición de patrón interno TPP al comienzo del análisis.


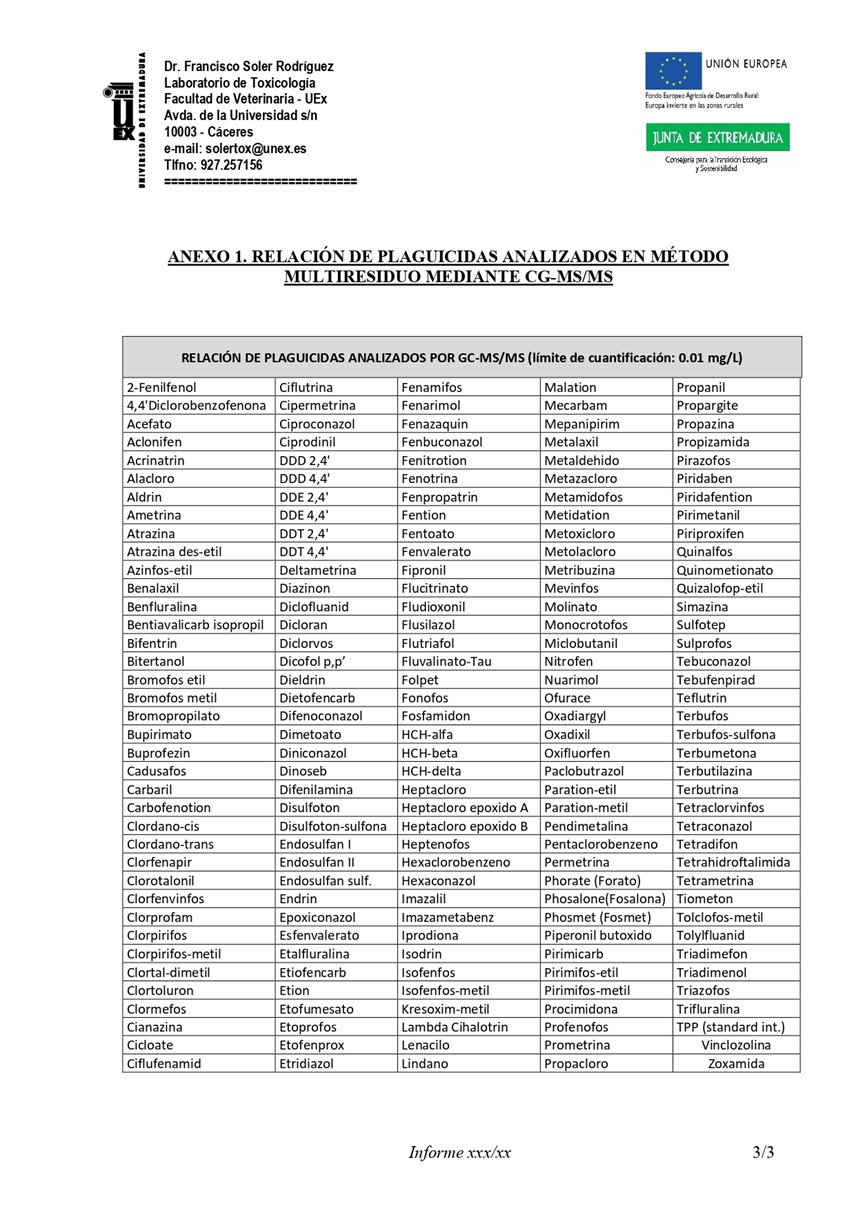
La relación completa de los 192 plaguicidas a analizar es la siguiente:
| RELACIÓN DE PLAGUICIDAS A ANALIZAR POR GC-MS/MS (límite de cuantificación: 0.01 mg/L) | ||||
|---|---|---|---|---|
| 2-Fenilfenol | Ciflutrina | Fenarimol | Mepanipirim | Propazina |
| 4,4 Diclorobenzofenona | Cipermetrina | Fenazaquin | Metalaxil | Propizamida |
| Acefato | Ciproconazol | Fenbuconazol | Metaldehido | Pirazofos |
| Aclonifen | Ciprodinil | Fenitrotion | Metazacloro | Piridaben |
| Acrinatrin | DDD 2,4 | Fenotrina | Metamidofos | Piridafention |
| Alacloro | DDD 4,4 | Fenpropatrin | Metidation | Pirimetanil |
| Aldrin | DDE 2,4 | Fention | Metiocarb | Piriproxifen |
| Ametrina | DDE 4,4 | Fentoato | Metoxicloro | Quinalfos |
| Atrazina | DDT 2,4 | Fenvalerato | Metolacloro | Quinometionato |
| Atrazina des-etil | DDT 4,4 | Fipronil | Metribuzina | Quizalofop-etil |
| Azinfos-etil | Deltametrina | Flucitrinato | Mevinfos | Simazina |
| Benalaxil | Diazinon | Fludioxonil | Molinato | Sulfotep |
| Benfluralina | Diclofluanid | Flusilazol | Monocrotofos | Sulprofos |
| Bentiavalicarb isopropil | Dicloran | Flutriafol | Miclobutanil | Tebuconazol |
| Bifentrin | Diclorvos | Fluvalinato-Tau | Nitrofen | Tebufenpirad |
| Bitertanol | Dicofol p,p | Folpet | Nuarimol | Teflutrin |
| Bromofos etil | Dieldrin | Fonofos | Ofurace | Terbufos |
| Bromofos metil | Dietofencarb | Fosfamidon | Oxadiargyl | Terbufos-sulfona |
| Bromopropilato | Difenoconazol | HCH-alfa | Oxadixil | Terbumetona |
| Bupirimato | Dimetoato | HCH-beta | Oxifluorfen | Terbutilazina |
| Buprofezin | Diniconazol | HCH-delta | Paclobutrazol | Terbutrina |
| Cadusafos | Dinoseb | Heptacloro | Paration-etil | Tetraclorvinfos |
| Carbaril | Difenilamina | Heptacloro epoxido A | Paration-metil | Tetraconazol |
| Carbofenotion | Disulfoton | Heptacloro epoxido B | Pendimetalina | Tetradifon |
| Carbofurano | Disulfoton-sulfona | Heptenofos | Pentaclorobenzeno | Tetrahidroftalimida |
| Clordano-cis | Endosulfan I | Hexaclorobenzeno | Permetrina | Tetrametrina |
| Clordano-trans | Endosulfan II | Hexaconazol | Phorate (Forato) | Tiometon |
| Clorfenapir | Endosulfan sulf. | Imazalil | Phosalone(Fosalona) | Tolclofos-metil |
| Clorotalonil | Endrin | Imazametabenz | Phosmet (Fosmet) | Tolylfluanid |
| Clorfenvinfos | Epoxiconazol | Iprodiona | Piperonil butoxido | Triadimefon |
| Clorprofam | Esfenvalerato | Isodrin | Pirimicarb | Triadimenol |
| Clorpirifos | Etalfluralina | Isofenfos | Pirimifos-etil | Triazofos |
| Clorpirifos-metil | Etiofencarb | Isofenfos-metil | Pirimifos-metil | Trifluralina |
| Clortal-dimetil | Etion | Kresoxim-metil | Procimidona | TPP (standard int.) |
| Clortoluron | Etofumesato | Lambda Cihalotrin | Profenofos | Vinclozolina |
| Clormefos | Etoprofos | Lenacilo | Prometrina | Zoxamida |
| Cianazina | Etofenprox | Lindano | Propacloro | |
| Cicloate | Etridiazol | Malation | Propanil | |
| Ciflufenamid | Fenamifos | Mecarbam | Propargite | |




2.3. Plaguicidas carbamatos.
Se utilizará la metodología QuEChERS adaptada por nosotros a contenido digestivo, posibles cebos envenenados y tejidos orgánicos de animales tal y como se ha descrito anteriormente. El extracto final se diluirá directamente en solvente y se analizará sin purificación mediante un equipo de cromatografía líquida de alta eficacia (HPLC) compuesto por un cromatógrafo líquido UHPLC 1290 Infinity II-QqQ 6470 de Agilent con detector de espectrometría de masas triple cuadrupolo con ionización mediante electrospray. Como control de calidad se hará control de blanco de reactivos y uso de TPP como patrón interno.
Los carbamatos a analizar son los siguientes:
— Aldicarb.
— Aldicarb sulfona.
— Aldicarb sulfóxido.
— Carbofurano.
— 3-Hidroxi-carbofurano.
— Carbaril.
— Metiocarb.
— Metomilo.
— Oxamilo.
— Propoxur.
2.4. Rodenticidas anticoagulantes.
Se utilizará la metodología QuEChERS adaptada a contenido digestivo, posibles cebos envenenados y tejidos orgánicos de animales consistente básicamente en una extracción directa con acetonitrilo (ACN), separación de la fase orgánica con acetato sódico anhidro y precipitación de las grasas por congelación siguiendo el método de Sell et al. (2017) adaptado (Soler et al., 2019).
En el caso de las heces es necesaria una liofilización previa que será seguida de extracción con solventes y purificación del extracto final según el método específico propuesto por Seljetun y cols. (2018). El extracto final se diluirá directamente en solvente y se analizará sin purificación mediante un equipo de cromatografía líquida de alta eficacia (HPLC) compuesto por un cromatógrafo líquido UHPLC 1290 Infinity II-QqQ 6470 de Agilent con detector de espectrometría de masas triple cuadrupolo con ionización mediante electrospray, una columna C-18 (100 mm x 2.1 mm 1,8 um), usando como fase móvil un gradiente ACN-H2O (0,01% HCOOH). Como control de calidad se hará control de blanco de reactivos y uso de patrón interno de warfarina deuterada (Warfarina D5).


Los raticidas anticoagulantes que se analizarán son los siguientes:
— Brodifacum.
— Bromadiolona.
— Clorofacinona.
— Coumatetralilo.
— Difacinona.
— Difenacum.
— Difetialona.
— Flocoumafen.
— Warfarina.
Bibliografía:
Seljetun, K.O., Eliassen, E., Karinen, R., Moe, L., Vindenes, V. (2018) Quantitative method for analysis of six anticoagulant rodenticides in faeces, applied in a case with repeated samples from a dog. Acta Veterinaria Scandinavica. 60 (1):1-11.
Sell B., T. Sniegocki, J. Zmudzki, y A. Posyniak. 2017. Development of an Analytical Procedure for the Determination of Multiclass Compounds for Forensic Veterinary Toxicology. Journal of Analytical Toxicology,1 9. DOI:10.1093/jat/bkx093.
Soler F, Oropesa AL, Míguez MP, Pérez-López M, Silva A. 2019. Aplicación de la metodología QuEChERS en el análisis de rodenticidas anticoagulantes en sangre e hígado. Revista de Toxicología 36:89-90.


2.5. Plaguicidas neurotóxicos.
Se utilizará la metodología QuEChERS adaptada a contenido digestivo, posibles cebos envenenados y tejidos orgánicos de animales tal y como se ha descrito para el método multirresiduo anteriormente adaptado en nuestro laboratorio (Soler et al., 2018).
El extracto final se diluirá directamente en solvente y se analizará sin purificación mediante un equipo de cromatografía líquida de alta eficacia (HPLC) compuesto por un cromatógrafo líquido UHPLC 1290 Infinity II-QqQ 6470 de Agilent con detector de espectrometría de masas triple cuadrupolo con ionización mediante electrospray. Como control de calidad se hará control de blanco de reactivos y uso de TPP como patrón interno.
Los plaguicidas neurotóxicos a analizar son los siguientes: Estricnina, Cloralosa y Metaldehído.
Bibliografía:
Soler F, Martínez-Morcillo S, Oropesa AL, Míguez MP, Pérez-López M, Silva A (2018). Aplicación de la metodología QuEChERS en el diagnóstico del envenenamiento por estricnina. Revista de Toxicología 35:75-76.
3. Análisis toxicológicos de intoxicaciones directas por cebos envenenados (efectos agudos) en muestras biológicas de fauna extremeña.
Tienen como objetivo la generación de conocimiento científico en relación con las pérdidas debidas al uso ilegal de cebos envenenados en el medio natural, y su incidencia en las diversas especies animales afectadas. Para ello se realizará un análisis químico de posibles cebos envenenados y de muestras orgánicas procedente de animales sospechosos de haber sido envenenados.
3.1. Toma de muestras.
La toma de muestras biológicas a analizar de los posibles procesos toxicológicos de fauna silvestre se realizará por personal de la Junta de Extremadura quien las remitirá, bien directamente o a través de otras entidades colaboradoras, al Laboratorio de Diagnóstico Toxicológico de la Facultad de Veterinaria de Cáceres.
Para cada muestra se incluirá información sobre la historia clínica, haciendo constar su fecha de recogida en el campo y el tratamiento recibido, en especial en lo referente al método de conservación de las mismas durante el proceso.


Las muestras preferentes para el estudio toxicológico serán:
— Cebos sospechosos.
— Plasma en animales vivos.
— Contenido digestivo.
— Sistema nervioso central e hígado.
3.2. Metodología.
Se realizará un análisis de las muestras para la búsqueda de los tóxicos más habituales utilizados en la fabricación de cebos envenenados (pesticidas organoclorados, organofosforados, carbamatos, estricnina, etc.).
Para ello se aplicarán, dependiendo de la sospecha en cada caso concreto, tanto técnicas de screening generales como técnicas para la identificación y cuantificación del tóxico. Para esto último se usarán preferentemente técnicas espectrofotométricas y cromatográficas (cromatografía en capa fina, cromatografía de gases con detectores específicos). En el apartado 2 del presente Anexo Técnico se describen las diferentes metodologías a emplear en función de los compuestos a analizar.
Asimismo, en el apartado 5 del presente ANEXO se indica la metodología a seguir por tipo de muestra empleada para la realización de los estudios toxicológicos.
Para cada muestra analizada se emitirá un INFORME DE ANÁLISIS TOXICOLÓGICO conforme al modelo incluido en el apartado 8 del presente ANEXO técnico.
4. Análisis toxicológicos de intoxicaciones indirectas por residuos de cebos envenenados o por contaminación ambiental (efectos a largo plazo) en muestras biológicas de fauna extremeña.
Tienen como objetivo la generación de conocimiento científico en relación con la situación actual de exposición a rodenticidas anticoagulantes en especies presa, y estudiar la utilidad de muestras no destructivas (heces) como medida indirecta de la exposición o carga de rodenticidas en los animales sin necesidad de su captura.
Actualmente, los RA más usados y detectados son los denominados de segunda generación (RASG) que son más tóxicos y de acción más duradera por su liposolubilidad y circulación enterohepática, acumulándose en el hígado, donde pueden permanecer durante meses (Vandenbroucke y col., 2008). Desde ahí son eliminados principalmente por las heces (Rached y col., 2020), detectándose incluso tras meses de la ingestión (Sage y col., 2010; Seljetun y col., 2018). Estos hechos indican que las heces pueden ser utilizadas como un método no cruento en la monitorización de la exposición a RA en fauna depredadora de roedores (ratas, ratones, conejo de monte ), y que además evita completamente el manejo directo de los animales, si bien es algo que no se aplica en los programas de monitorización.


Entre los contaminantes ambientales de alta repercusión en la fauna silvestre se encuentran los elementos inorgánicos (metales como el plomo, cadmio y mercurio, y metaloides como el arsénico y el selenio). De especial interés es la posible exposición al plomo debido a la ingestión de presas por parte de los linces, básicamente conejos afectados por contaminación ambiental o por disparos de cazadores con presencia de perdigones de plomo en su cuerpo.
4.1. Toma de muestras.
La toma de muestras biológicas a analizar de los posibles procesos toxicológicos de fauna silvestre se realizará en campo por personal de la Junta de Extremadura.
Las muestras biológicas serán entregadas inicialmente al Centro de Recuperación de Fauna Silvestre de la Junta de Extremadura, desde donde se remitirán al Laboratorio de Diagnóstico Toxicológico de la Facultad de Veterinaria de Cáceres.
Para cada muestra se incluirá información sobre la historia clínica, haciendo constar la fecha de la recogida de la muestra en el campo y su tratamiento en el referido centro, en especial en lo referente al método de conservación de las mismas durante el proceso.
Las muestras a obtener serán de hígado de conejos de monte capturados/cazados y muestras de sangre heparinizada (aprox. 2mL) y heces de ejemplares de fauna depredadora de roedores.
Si la Dirección General de Sostenibilidad lo estima oportuno, y con el objeto de mejorar la información cualitativa del estudio, además de las muestras biológicas tomadas en el periodo de ejecución del presente Convenio, los análisis podrán incluir muestras de sangre almacenadas en el en el Laboratorio de Diagnóstico Toxicológico de la Facultad de Veterinaria de Cáceres pertenecientes a diferentes muestras tomadas desde el año 2019.


4.2. Metodología.
Se realizará un análisis de las muestras (hígado de conejo, sangre y heces de fauna depredadora de roedores) para la búsqueda de los rodenticidas anticoagulantes que se citan en el apartado 2.4 del presente Anexo Técnico, utilizando la metodología de extracción y de identificación cromatográfica que se indica. Además, en la sangre de fauna depredadora de roedores) se realizará un análisis de elementos químicos tóxicos (plomo, cadmio, mercurio, arsénico y selenio) mediante polarografía y ICP-MS, contaminantes ambientales de especial interés en medio ambiente y citados en el apartado 2.1 del presente Anexo.
Asimismo, en el apartado 5 del presente ANEXO se indica la metodología a seguir por tipo de muestra empleada para la realización de los estudios toxicológicos.
Para cada muestra analizada se emitirá un INFORME DE ANÁLISIS TOXICOLÓGICO conforme al modelo incluido en el apartado 8 del presente ANEXO técnico.
5. Detalle de análisis por tipo de muestra.
5.1. Muestra de hígado, contenido gástrico, contenido de buche, cebo u otra similar.
Se someterá a los siguientes análisis:
a) Análisis multiresiduo de plaguicidas.
1. Extracción de la muestra con solventes orgánicos (acetonitrilo+agua) y obtención de un extracto que será purificado mediante exposición a sales minerales (MgSO4, NaCl y NaOAC), reactivos QuEChERS (PSA y C18) y mediante precipitación de la materia grasa mediante congelación y centrifugación.
2. Análisis del extracto purificado mediante equipo de cromatografía de gases con detector de masas triplecuadrupolo (GC-MS/MS), para la identificación y cuantificación de los plaguicidas organoclorados, organofosforados, piretroides y otros (diversos herbicidas y antifúngicos) que aparecen en el Anexo (total: 192 plaguicidas).
El equipo GC-MS/MS está formado por un cromatógrafo de gases 45-GC Bruker equipado con un detector Scion Triple Quadrupole detector (Bruker). Las condiciones del equipo son controladas con MS Work Station software version 6.8 (Bruker, Germany). La columna cromatográfica es DB-5MS (30 m x 0.25 mm, 0.25 µm, Agilent- Technologies; Santa Clara, CA).


b) Análisis específico de insecticidas carbamatos.
1. Extracción de la muestra con solventes orgánicos (acetonitrilo+agua) y obtención de un extracto que será purificado mediante exposición a sales minerales (MgSO4 , NaCl y NaOAC), reactivos QuEChERS (PSA y C18) y mediante precipitación de la materia grasa mediante congelación y centrifugación.
2. Análisis del extracto purificado mediante equipo de cromatografía de líquidos con detector de masas triplecuadrupolo (HPLC-MS/MS), para la identificación y cuantificación de los siguientes insecticidas carbamatos: Aldicarb, Aldicarb sulfona, Aldicarb sulfóxido, Carbofurano, 3-Hidroxi-carbofurano, Carbaril, Metiocarb, Metomilo, Oxamilo y Propoxur.
El equipo HPLC-MS/MS está formado por un cromatógrafo líquido Agilent 1260 series Infinity II chromatograph y un detector Agilent 6470 Triple Quadrupole LC/MS con fuente de ionización ESI (Electrospray Ionization Source). La columna cromatográfica es Eclipse column Poroshell-C18 (2.1 × 100 mm, 2,7 m).
c) Análisis específico de rodenticidas anticoagulantes.
1. Extracción de la muestra con solvente orgánico (acetonitrilo) y obtención de un extracto que será purificado mediante exposición a sales minerales (MgSO4, NaCl y NaOAC), reactivos QuEChERS (PSA y C18) y mediante precipitación de la materia grasa mediante congelación y centrifugación.
2. Análisis del extracto purificado mediante el equipo de cromatografía de líquidos con detector de masas triplecuadrupolo (HPLC-MS/MS) antes indicado, para la identificación y cuantificación de los siguientes rodenticidas anticoagulantes: Brodifacum, Bromadiolona, Clorofacinona, Coumatetralilo, Difacinona, Difenacum, Difetialona, Flocoumafen y Warfarina.
d) Análisis específico de compuestos neurotóxicos.
1. Extracción de la muestra con solvente orgánico (acetonitrilo+agua) y obtención de un extracto que será purificado mediante exposición a sales minerales (MgSO4, NaCl y NaOAC), reactivos QuEChERS (PSA y C18) y mediante precipitación de la materia grasa mediante congelación y centrifugación.
2. Análisis del extracto purificado mediante equipo de cromatografía de líquidos con detector de masas triplecuadrupolo (HPLC-MS/MS) antes indicado, para la identificación y cuantificación de los siguientes compuestos neurotóxicos: Estricnina, Metaldehido y Cloralosa.


5.2. Muestra de Sistema Nervioso Central (cerebro).
Se someterá a los siguientes análisis:
a) Análisis de la actividad acetilcolinesterasa.
1. Tras homogeneización en tampón TRIS y centrifugación, el sobrenadante es sometido a un estudio cinético de actividad enzimática tras añadirle su sustrato enzimático especifico (yoduro de acetiltiocolina) durante 5 minutos en un espectrofotómetro UV/VIS Shimadzu UV-1800 a una longitud de onda de 410 nm.
b) Estudio de reactivación de la actividad acetilcolinesterasa.
Una alicuota del sobrenadante anterior es incubada con pralidoxima (2-PAM) que es un reactivador específico de la inhibición por organofosforados (reactivación con 2-PAM) y posteriormente incubado con el sustrato enzimático anterior y analizada la actividad enzimática en las mismas condiciones descritas anteriormente.
Otra alicuota del sobrenadante anterior es diluida en tampón TRIS para una reactivación de la inhibición por carbamatos (reactivación por dilución) y posteriormente incubado con el sustrato enzimático anterior y analizada la actividad enzimática en las mismas condiciones descritas anteriormente.
5.3. Muestras de sangre.
Se someterá a los siguientes análisis:
a) Análisis de rodenticidas anticoagulantes.
Se realizará mediante metodología QuEChERS adaptada a sangre para la extracción de los RA utilizando acetonitrilo como solvente. La identificación y cuantificación en el extracto final de los distintos RA se realizará por cromatografía líquida de alta eficacia (HPLC) utilizando un cromatógrafo líquido UHPLC 1290 Infinity II-QqQ 6470 de Agilent con detector de masas triple cuadrupolo.
b) Análisis de elementos químicos (plomo, cadmio, mercurio, arsénico y selenio).
Se realizará una digestión ácida en un horno microondas automatizado y sobre el extracto digerido se analizarán los elementos indicados utilizando un equipo de polarografía Methrom® y un equipo de ICP-MS (NexION 300D con automuestreador de PerkinElmer®) que permiten el análisis simultáneo de los diversos elementos químicos.


5.4. Análisis de muestras de heces.
El análisis de las muestras de heces, tras liofilización, extracción con solventes y purificación del extracto final se realizará según el método específico propuesto por Seljetun y cols. (2018). Previo al análisis de las muestras se hará la validación del método mediante el establecimiento de los siguientes parámetros: efecto matriz, límite de cuantificación, recuperación y variabilidad en muestras fortificadas. La identificación y cuantificación en el extracto final de los distintos RA se realizará por cromatografía líquida de alta eficacia (HPLC) utilizando el equipo anteriormente citado.
5. Bibliografía.
Fraser D, Mouton A, Serieys LEK et al. (2018). Genome-wide expression reveals multiple systemic effects associated with detection of anticoagulant poisons in bobcats (Lynx rufus). Mol Ecol. 27:1170 87.
Rached A, Moriceau M-A, Serfaty X, Lefebvre S and Lattard V (2020) Biomarkers Potency to Monitor Non-target Fauna Poisoning by Anticoagulant Rodenticides. Front. Vet. Sci. 7:616276.
Sage M, Fourel I, Coeurdassier M, Barrat J, Berny P, Giraudoux P. (2010). Determination of bromadiolone residues in fox faeces by LC/ESI MS in relationship with toxicological data and clinical signs after repeated exposure. Environ Res. 110:664 74.
Serieys L.E.K. et al. (2018). Urbanization and anticoagulant poisons promote immune dysfunction in bobcats. Proc. R. Soc. B 285: 20172533.
Seljetun, K.O., Eliassen, E., Karinen, R., Moe, L., Vindenes, V. (2018) Quantitative method for analysis of six anticoagulant rodenticides in faeces, applied in a case with repeated samples from a dog. Acta Veterinaria Scandinavica. 60 (1):1-11.
Taylor, M.J., Giela, A., Senior, C., Sharp, E.A., Titman, C.M., Luzardo, O.P., Ruiz-Suárez, N. (2018) Multi-residue determination of anticoagulant rodenticides in vertebrate wildlife and domestic animals using Ultra (High) Performance Liquid Chromatography Tandem Mass Spectrometry. MethodsX 5: 149 158.
Taylor, M.J., Giela, A., Sharp, E.A., Senior, C., Vyas, D.S. (2019) A rapid multi-class, multi-residue UHPLC-MS/MS method for the simultaneous determination of anticoagulant rodenticides, pesticides and veterinary medicines in wild animals, pets and livestock. Analytical Methods 8: 991-1146.


Vandenbroucke, V., Bousquet-Melou, A., de Backer, P., Croubels, S. (2008) Pharmacokinetics of eight anticoagulant rodenticides in mice after single oral administration. Journal of Veterinary Pharmacologic and Therapeutics 31: 437-445.
Vudathala, D., Cummings, M., Murphy, L. (2010) Analysis of Multiple Anticoagulant Rodenticides in Animal Blood and Liver Tissue Using Principles of QuEChERS Method. Journal of Analytical Toxicology 34(5):273-9.
Watt BE, Proudfoot AT, Bradberry SM, Vale JA. (2005). Anticoagulant rodenticides. Toxicol Rev. 24:259 69.
6. Detalle, planificación y costes de los trabajos a realizar.
| DESCRIPCIÓN | IMPORTE (€) | CERTIFICACIÓN (€) | ||||||
|---|---|---|---|---|---|---|---|---|
| Parcial 2023 | Final 2024 | |||||||
| Estudio de las interacciones entre sustancias químicas tóxicas y la fauna extremeña, debido a la exposición a las mismas a través de cebos envenenados o por contaminación ambiental. | ||||||||
| Desglose económico: | ||||||||
| 1. Recursos materiales: equipos y material inventariable | 0,00 | 0,00 | 0,00 | |||||
| 2. Recursos materiales: material fungible | 6.200,00 | 3.200,00 | 3.000,00 | |||||
| 3. Servicios: mantenimiento/reparación de equipos/instalaciones | 0,00 | 0,00 | 0,00 | |||||
| 4. Recursos humanos | 69.600,00 | 37.600,00 | 32.000,00 | |||||
| 5. Viajes y dietas | 5.000,00 | 2.000,00 | 3.000,00 | |||||
| TOTAL | 80.800,00 | 42.800,00 | 38.000,00 | |||||


7. Indicadores.
Con objeto de garantizar la validez científica del estudio a continuación se establece el número mínimo estimado de análisis a realizar por anualidad y tipología:
| Tipo de analítica | ANUALIDAD | |||
|---|---|---|---|---|
| 2023 | 2024 | |||
| Análisis toxicológicos de intoxicaciones directas por cebos envenenados (efectos agudos) en muestras biológicas de fauna silvestre extremeña. | ||||
| Análisis multirresiduo de plaguicidas y de plaguicidas carbamatos | 116 | 85 | ||
| Análisis de rodenticidas y de neurotóxicos | 116 | 85 | ||
| Análisis de acetilcolinesterasa | 24 | 15 | ||
| Subtotal | 256 | 185 | ||
| Análisis toxicológicos de intoxicaciones indirectas por residuos de cebos envenenados o por contaminación ambiental (efectos a largo plazo) en muestras biológicas de fauna extremeña. | ||||
| Análisis de metales y de rodenticidas en sangre de fauna depredadora de roedores | 60 | 40 | ||
| Análisis de rodenticidas en heces de fauna depredadora de roedores | 50 | 50 | ||
| Análisis de rodenticidas hígado conejo | 60 | 40 | ||
| Subtotal | 170 | 130 | ||
| TOTAL | 426 | 315 | ||


8. Contenido del estudio a elaborar en el marco del presente convenio.
El contenido del Estudio establecido en la cláusula 4 del Convenio, y que servirá como base para la elaboración de las memorias parciales y finales, será el siguiente:
ESTUDIO DE LAS INTERACCIONES ENTRE SUSTANCIAS QUÍMICAS TÓXICAS Y LA FAUNA EXTREMEÑA, DEBIDO A LA EXPOSICIÓN A LAS MISMAS A TRAVÉS DE CEBOS ENVENENADOS O POR CONTAMINACIÓN AMBIENTAL.
1. Desplazamiento de personal del Grupo de investigación en Toxicología en aquellas tomas de muestras en campo que impliquen conocimientos técnicos especiales en toxicología y a reuniones técnicas relativas al convenio.
2. Desplazamientos a los laboratorios del SAIUEX para traslado de muestras y/o extractos y reuniones técnicas de discusión de resultados.
3. Análisis toxicológico (método multirresiduo) en cebos, contenido gástrico e hígado de plaguicidas organoclorados, organofosforados, carbamatos, piretroides, fungicidas y otros, mediante la técnica de cromatografía de gases con detector MS/MS, para el estudio de intoxicaciones directas y agudas relacionadas con la colocación de cebos envenenados
4. Análisis toxicológicos específicos en cebos, contenido gástrico e hígado de plaguicidas carbamatos, rodenticidas anticoagulantes y plaguicidas neurotóxicos (estricnina, metaldehído y cloralosa), mediante la técnica de cromatografía de líquidos (HPLC) con detector MS/MS, para el estudio de intoxicaciones directas y agudas relacionadas con la colocación de cebos envenenados.
5. Análisis en cerebro de la actividad acetilcolinesterasa y su reactivación como biomarcador de exposición y efecto a los principales compuestos (plaguicidas anticolinesterásicos) usados en la elaboración de los cebos envenenados.
6. Interpretación y valoración de los efectos agudos de los resultados obtenidos en el estudio toxicológico relativo a los cebos envenenados.
7. Análisis de rodenticidas anticoagulantes en sangre e hígado de especies de fauna extremeña (presas y sus depredadores) como residuos de cebos envenenados o por contaminación ambiental mediante HPLC con detector MS/MS.


8. Análisis de rodenticidas anticoagulantes en heces de especies depredadoras de fauna extremeña para estudiar su utilidad como muestras no invasivas o destructivas en la biomonitorización de esos compuestos.
9. Análisis de contaminantes inorgánicos (plomo, cadmio, mercurio, arsénico y selenio) en muestras biológicas de especies de fauna extremeña mediante las técnicas ICP-MS y/o polarografía.
10. Valoración e interpretación de los resultados analíticos, con estimación de los efectos crónicos a largo plazo, de intoxicaciones indirectas por residuos de cebos envenenados o de contaminantes ambientales (rodenticidas y metales) en muestras biológicas de fauna extremeña.
9. Informe de análisis toxicológico.









Nota: Este texto carece de valor jurídico. Para consultar la versión oficial y auténtica puede acceder al fichero PDF del DOE.
Subir ^
Otras Opciones
2025 © Junta de Extremadura. Todos los derechos reservados
 Normativa ELI
Normativa ELI

 RSS
RSS
 Accesibilidad
Accesibilidad
 Mapa del sitio
Mapa del sitio
 Aviso Legal
Aviso Legal
 Normativa ELI
Normativa ELI

 Accesibilidad
Accesibilidad
 Mapa del sitio
Mapa del sitio
 Aviso Legal
Aviso Legal




